Réaction de déplacement

- 4728
- 329
- Anaïs Julien
Nous expliquons quelles sont les réactions de déplacement, les types qui existent et donnent plusieurs exemples
 La réaction entre le cuivre métallique et une solution de nitrate d'argent est une réaction de déplacement qui produit du nitrate de cuivre (II) (qui donne à la solution une coloration bleu verdâtre) et de l'argent métallique qui se développe sous la forme d'un gris argent duvet de couleur de couleur
La réaction entre le cuivre métallique et une solution de nitrate d'argent est une réaction de déplacement qui produit du nitrate de cuivre (II) (qui donne à la solution une coloration bleu verdâtre) et de l'argent métallique qui se développe sous la forme d'un gris argent duvet de couleur de couleur Qu'est-ce qu'une réaction de déplacement?
La Réaction de déplacement o La réaction de remplacement est un type de réaction chimique dans laquelle un atome ou un petit groupe d'atomes dans une molécule est remplacé ou déplacé par un autre atome ou groupe d'atomes.
Les réactions de déplacement peuvent être simples ou doubles et sont de nature très fréquente. Beaucoup de réactions chimiques que nous voyons quotidiennement sont des réactions de déplacement, comme la sulfatation des terminaux dans les batteries de voitures.
Types de réactions de déplacement
Il existe deux types de réactions de déplacement, simples et doubles, qui sont décrites ci-dessous avec quelques exemples spécifiques:
Réaction de déplacement simple
Ce sont des réactions de déplacement dans lesquelles un élément en remplace un autre dans un composé chimique. Ils sont reconnus car à la fois dans les réactifs et dans les produits, il n'y a que deux substances impliquées, et dans chaque cas, l'un d'eux est un élément pur tandis que l'autre est un composé.
Ces réactions peuvent avoir l'une des équations générales suivantes:
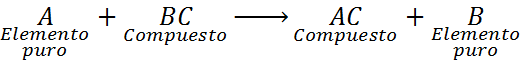
Comme on peut le voir, dans cette réaction, l'élément A réagit avec le composé BC et déplace ou remplace l'élément B pour former le composé AC.
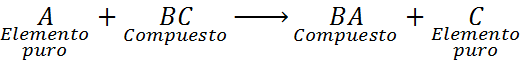
Dans ce cas, l'élément A réagit également avec le composé de la Colombie-Britannique, mais déplace ou remplace l'élément C pour former le composé BA, libérant C sous la forme d'un élément pur.
L'une des caractéristiques les plus importantes pour reconnaître une simple réaction de déplacement est que l'élément entrant doit finir par occuper le même endroit qui occupait l'élément sortant (B ou C, que le cas peut l'être) et cela doit se terminer comme un élément pur.
Il peut vous servir: Gallium arseniuro: structure, propriétés, utilisations, risqueIl convient de noter que, dans de nombreux cas, la partie C de la molécule n'est pas nécessairement un élément individuel, mais qu'il peut s'agir d'un groupe d'atomes tels que les ions nitrate (non3-) ou sulfate (donc4-).
Exemples de réactions de déplacement simples
- Déplacement en argent par cuivre
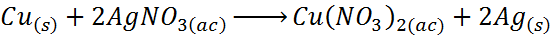
Dans ce cas, le cuivre (Cu) agit pour l'élément A, Silver (AG) correspond aux ions élément B et nitrate (non3-) représente C.
Comme vous pouvez le voir, dans cette réaction, le cuivre remplace l'argent en nitrate d'argent, libérant l'argent de manière élémentaire.
- Sulfatation des bornes de batterie

Cette réaction de déplacement simple est ce qui se passe dans les terminaux ou les contacts électriques de nombreux accumulateurs de plomb, c'est-à-dire les batteries présentes dans la plupart des voitures à essence.
La réaction est mise en évidence par la formation d'un solide blanc qui couvre les contacts de plomb de ces batteries. Comme on peut le voir dans l'équation, il s'agit d'une réaction dans laquelle le plomb déplace l'hydrogène dans l'acide sulfurique.
- Déplacement du brome par fluorure

Dans ce cas, le fluorure, qui est un élément très réactif, remplace le brome dans le bromure de sodium (NABR) pour former du fluorure de sodium (NAF). Notez que ici l'élément qui est remplacé n'est pas celui qui apparaît en premier dans la formule composée, mais que c'est la seconde, comme dans la deuxième forme de la réaction générale précédemment montrée.
Il peut vous servir: distillation fractionnée: processus, équipement, applications, exemplesRéaction à double déplacement
Les réactions à double déplacement, également appelées réactions à double remplacement ou à double décomposition, peuvent être considérées comme un échange de couples. Ce sont des réactions dans lesquelles deux composés chimiques différents échangent des éléments pour former deux nouveaux composés différents. Ces réactions ont l'équation générale suivante:
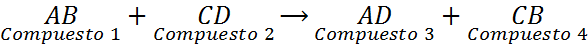
Comme on peut le voir dans cette réaction générale, l'élément A du composé 1 (AB) remplace le composé 2 élément (CD) pour former le composé 3 (AD). Dans le même temps, l'élément C du composé 2 (CD) remplace l'élément A du composé 1 (AB) pour former le composé 4 (CB).
Dans les déplacements doubles, il est essentiel que les éléments qui sont remplacés entre eux occupent des positions équivalentes dans les nouveaux composés. Cela signifie que, dans la réaction générale, a, qui est à gauche et donc c'est probablement un cation, ne peut remplacer C que dans le composé de CD, mais ne peut pas remplacer d.
Ceci est similaire à un échange de couples de danse. Si tous les couples sont formés par un homme et une femme, les nouveaux couples formés après la réaction doivent également être formés par un homme et une femme.
Exemples de réactions à double déplacement
- Réaction entre le chlorure de sodium et le nitrate d'argent

Ceci est un exemple clair d'une réaction à double déplacement. Ici, le sodium remplace l'argent en nitrate d'argent pour former du nitrate de sodium (nano3), En même temps que l'argent remplace le sodium dans du chlorure de sodium pour former du chlorure d'argent (AGCL).
Il peut vous servir: péride- Réaction entre le sulfate de calcium et le chlorure de sodium

Dans cette réaction à double déplacement, le calcium remplace le sodium dans le chlorure de sodium pour former du chlorure de calcium tandis que le sodium remplace le calcium dans le sulfate de calcium pour former le sulfate de sodium ainsi.
Une autre façon de voir cette réaction qui est également valide est que le sulfate remplace le chlorure dans le chlorure de sodium pour former du sulfate de sodium pendant que le chlorure remplace le sulfate.
Bien que les deux formulaires soient tout aussi acceptables, le premier est plus courant que le second.
- Réaction entre l'acide sulfurique et l'hydroxyde de potassium
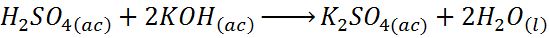
La réaction entre l'acide sulfurique et l'hydroxyde de potassium est une réaction de neutralisation basée sur l'acide de base, mais c'est aussi une réaction à double déplacement.
Dans ce cas, l'hydrogène remplace le potassium dans l'hydroxyde de potassium pour former l'eau, tandis que le potassium remplace l'hydrogène dans l'acide sulfurique pour former du sulfate de potassium.

