Radicaux louer la façon dont ils se forment, la nomenclature, les exemples
- 991
- 96
- Raphaël Charles
Les Loyer des radicaux Ils sont un ensemble de molécules instables qui proviennent de la perte d'hydrogènes d'un alcane. Ils sont caractérisés par un électron disparu, ils réagissent donc rapidement pour compléter l'octet de Valence de l'atome où il est situé.
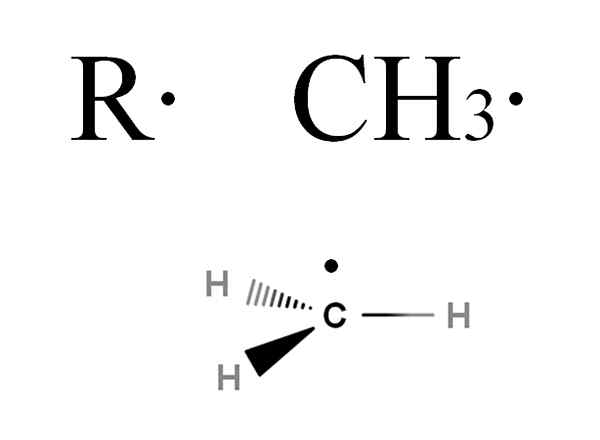
Ces radicaux sont symbolisés par la lettre R, tout comme les groupes de location, mais avec la différence qu'un point est ajouté, r ·. Ce point indique que la présence d'un électron a disparu. Par exemple, considérez le gaz méthane, CHO4. Cet alcane, perdant l'un de ses hydrogènes, sera transformé en méthyle radical3· (Image ci-dessous).
 Formule générale d'un alkyle radical et du méthyle radical. Source: Gabriel Bolívar via Molview.
Formule générale d'un alkyle radical et du méthyle radical. Source: Gabriel Bolívar via Molview. Si vous voulez approfondir un peu la structure radicale ch3·, On verra que son électron disparu est à un angle perpendiculaire aux liaisons C-H; c'est-à-dire qu'il est situé dans une orbitale p pur. Par conséquent, Cho3· Adopter une hybridation SP2, ainsi que, généralement, avec d'autres radicaux alkyle.
Ces radicaux sont la pierre angulaire des réactions en chaîne où les alcanes participent, comme c'est le cas de leurs halogénations: chloration, bromation, etc. Il y a des radicaux des 1er, 2e et 3e, ainsi que du vinyle et de l'alilique, chacun avec sa stabilité et leur facilité de formation respectives.
[TOC]
Comment les radicaux sont-ils formés alkyle?
La réaction "plus simple" pour laquelle se forment des radicaux est l'halogénation des alcanes. Pour se former, la réaction en chaîne doit être donnée, qui ne se produit qu'à des températures élevées (dépassant 250 ºC), ou sous l'incidence de la lumière ultraviolette à température ambiante.
Peut vous servir: sulfite de sodium (NA2SO3)Considérez la chloration du méthane dans l'une des conditions mentionnées ci-dessus:
CL2 → 2Cl ·
L'énergie fournie est suffisante pour briser la liaison Cl-Cl de la molécule de chlore, se produisant une rupture homolitique; c'est-à-dire que chaque atome de chlore reste avec l'un des électrons de liaison. Par conséquent, deux radicaux sont formés.
Ensuite, un Cl · radical attaque une molécule de méthane:
Cl · + ch4 → HCL + CH3·
Et le méthyle radical apparaît. Ce ch3· Il est assez instable, il réagira donc immédiatement pour gagner un électron supplémentaire avec lequel il apparaîtra son seul électron:
Ch3· + CL2 → CH3Cl + Cl ·
Le formé réagira avec une autre molécule de méthane et le cycle sera répété encore et encore. Au fur et à mesure que le méthane s'épuise, les réactions suivantes se produiront qui mettra fin à la réaction en chaîne:
Cl · + · Cl → Cl2
Ch3· + · Cho3 → CH3Ch3
Ch3· + · Cl → ch3CL
Stabilité relative
Ch3
Le méthane n'est pas le seul alcane qui est "radicalisé" par chloration. Cela se produit également de la même manière avec l'éthane, le propane, le butane et d'autres isomères. Cependant, ce qui varie, c'est l'énergie nécessaire qui doit être fournie afin que les radicaux soient déshydrogate une molécule d'alcane. Dans le cas du radical méthyle, il est très instable et, par conséquent, difficile à former.
Ainsi, le cho radical3Ch2· Il est plus stable et facile à former que Cho3·. Parce que? Parce que le CH radical3Ch2· Il est primaire, 1er, ce qui signifie que l'électron disparu se trouve sur un atome de carbone lié à un autre carbone. En attendant, Cho3Dès qu'il est lié aux atomes d'hydrogène.
Peut vous servir: fluorure: historique, propriétés, structure, obtention, risques, utilisationsCa parle de quoi? Se souvenant de la représentation précédente, l'électron disparu est situé dans une orbitale p, perpendiculaire aux autres liens. Pouce3·, Les atomes d'hydrogène donnent à peine une densité électronique à l'atome de carbone, dans le but de compenser l'absence d'un autre électron.
1er
Pouce3Ch2·, En revanche, le carbone avec l'électron disparu est lié à deux hydrogènes et à un groupe méthyle. Par conséquent, ce carbone reçoit une plus grande densité électronique, ce qui aide à stabiliser l'électron disparu un peu. La même explication est valable pour les autres radicaux alcynd 1er alcynd.
2e
Dans un secondaire radical ou 2ème alquil, comme le radical isopropile (ch3)2C. Par conséquent, il est plus stable que les radicaux 1er et méthyl.
3e
Nous avons également des radicaux tertiaires ou 3e alcynd, tels que les radicaux ter-butyl3)3C ·. Ce sont plus stables que les 1er et 2e. Maintenant, il y a trois groupes carbonatés différents de l'atome d'hydrogène qui stabilisent l'électron disparu.
Allylique et vinyle
Il convient également de mentionner les radicaux allyliques, Cho2= Ch-ch2·, Et vinyle, cho2= Ch ·.
Alilic est le plus stable de tous. En effet, l'électron disparu est même capable de se déplacer vers l'atome de carbone de l'autre extrémité. Le Vínilico, en revanche, est le plus instable de tous, car le groupe CHO2=, plus d'acide, attire la densité électronique vers elle-même au lieu de le donner au carbone avec l'électron a disparu.
Peut vous servir: Hydroxyde de plomb: structure, propriétés, utilisations, risquesEn résumé, la stabilité relative des radicaux alcynd, du plus élevé au plus bas, sont:
Alilo> 3e> 2e> 1er> vinyle
Nomenclature
La nomenclature des radicaux alkyl est la même que pour le remedie. Ainsi, Cho3Ch2· Est appelé radical éthylique; et le ch radical3Ch2Ch2Ch3, n-butyle.
Loyer des radicaux principaux
Les principaux radicaux alkyles coïncident avec les groupes alkyle: ce sont ceux qui ont moins de six atomes de carbone. Par conséquent, les radicaux sont dérivés du méthane, de l'éthane, du propane, du butane et du pentano, sont les plus courants. De même, le vinyle radical et les alicos font partie de cette liste.
D'autres radicaux alcynd qui se trouvent moins fréquemment sont ceux qui dérivent de cycloalcanos, comme le cyclobutane, le cyclobutane ou le cyclopentano.
Dans l'image suivante, plusieurs de ces radicaux sont représentés avec des lettres attribuées:
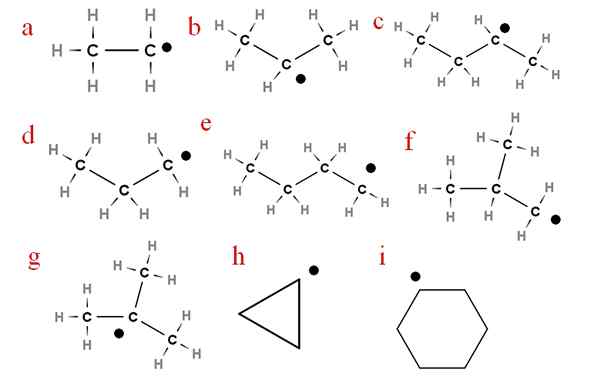 Neuf des radicaux Alcheery les plus importants. Source: Gabriel Bolívar.
Neuf des radicaux Alcheery les plus importants. Source: Gabriel Bolívar. En commençant par la lettre «A», nous avons:
-A, radical éthylique
-B, radical isopropylique
-C, radical secbutyl
-D, propyl radical
-E, radical n-butyle
-F, radical isobutil
-G, radical ter-butyl
-H, Cycropilus radical
-I, Radical Cyclohexil
Chacun de ces radicaux peut ou non faire remplacer leurs hydrogènes par d'autres groupes, ils sont donc également variés que les alcanes et leurs isomères structurels.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Alkyle. Récupéré de: dans.Wikipédia.org
- CHIMISTER BOOLISTexts. (5 juin 2019). Structure des radicaux alkyle: hyperconjugaison. Récupéré de: Chem.Bibliothèque.org
- « Concept de références croisées, fonctions, exemples
- Caractéristiques des animaux aquatiques, respiration, types, exemples »

