Qu'est-ce que la théorie du groupe?
- 1947
- 183
- Prof Ines Gaillard
Qu'est-ce que la théorie du groupe?
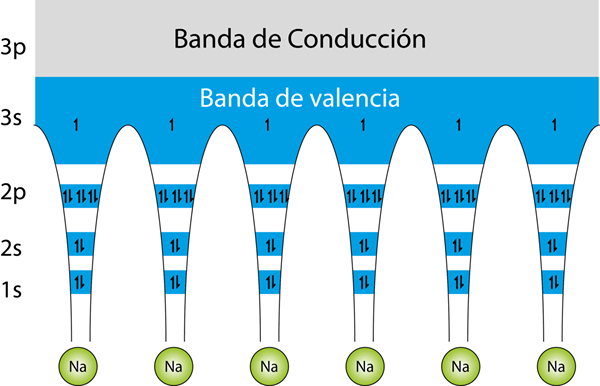
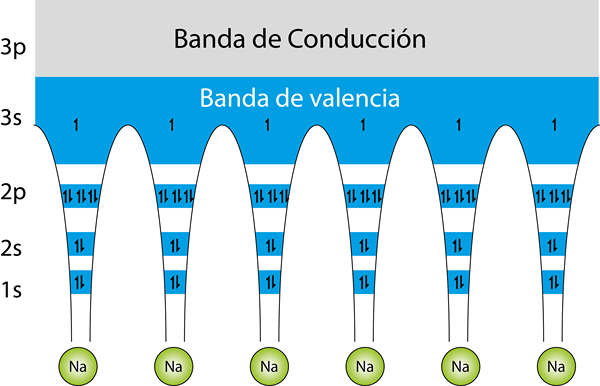 Structure des bandes d'énergie pour un verre de sodium métallique. Les flèches représentent les électrons. Chaque atome de sodium a 11 électrons. 10 d'entre eux sont en orbitales internes, et le seul électron à Valence est situé dans la bande de Valence, tandis que la bande de conduite est vide
Structure des bandes d'énergie pour un verre de sodium métallique. Les flèches représentent les électrons. Chaque atome de sodium a 11 électrons. 10 d'entre eux sont en orbitales internes, et le seul électron à Valence est situé dans la bande de Valence, tandis que la bande de conduite est vide La Théorie de la bande Il est utilisé pour expliquer comment les atomes métalliques se lient les uns aux autres et pourquoi ils sont de si bons conducteurs d'électricité tandis que d'autres matériaux sont isolants. En d'autres termes, C'est une théorie qui explique comment fonctionne le lien métallique.
Dans n'importe quel morceau de métal, comme dans un clou ou dans un morceau de câble en cuivre, par exemple, les atomes sont très proches et très proches les uns des autres.
Selon la théorie des bandes, en raison de cette proximité, ses orbitales atomiques (l'endroit où se trouvent leurs électrons) sont mélangés pour former une seule orbitale géante qui ressemble à un «groupe» plus qu'une orbitale qu'une orbitale.
Lorsque cela se produit, deux bandes se forment essentiellement qui sont la bande de Valence et la bande de conduite (c'est pourquoi le pluriel en théorie de la bande).
Le groupe Valence
Cette bande est formée par la combinaison des orbitales de valence de chaque atome. Ce sont les dernières orbitales occupées par des électrons dans chaque atome individuel.
La bande Valence est l'endroit où les électrons d'un métal sont situés lorsque les atomes sont détendus. Autrement dit, lorsqu'ils n'ont pas été excités par l'application d'un potentiel électrique, par exemple.
La bande de conduite
La bande de conduite est formée par la combinaison des premières orbitales inoccupées ou vides de chaque atome. Habituellement, la bande de conduite est formée par des orbitales P ou D qui se chevauchent. Cela donne naissance à une bande qui ressemble à une autoroute qui passe à travers l'espace qui est au-dessus et en dessous des couches d'atomes.
Peut vous servir: bases faiblesLorsqu'un électron entre dans la couche de conduite, il est dit qu'il est «démocalisé», car il peut être déplacé librement d'un endroit à un autre, et n'est pas situé autour d'un atome particulier.
Une analogie utile
Pour mieux comprendre quelle est la structure des bandes formées en métaux, il est pratique d'utiliser certaines analogies.
Nous pouvons imaginer un solide de n'importe quelle substance comme s'il s'agissait d'un immeuble dans lequel chaque appartement représente un atome, et à l'intérieur de chaque appartement, les chambres avec leur lit respectif peuvent être considérées comme les orbitales où les électrons résident.
 Un solide peut être imaginé comme un immeuble dans lequel chaque appartement est un atome, et les électrons qui y sont trouvés peuvent se déplacer d'un appartement à un autre
Un solide peut être imaginé comme un immeuble dans lequel chaque appartement est un atome, et les électrons qui y sont trouvés peuvent se déplacer d'un appartement à un autre En un Matériau non conducteur, Tous les électrons sont situés autour de leur atome respectif. Esto es lo mismo que decir que cada apartamento está cerrado y los electrones no son libres de moverse de un “apartamento” a otro (es decir, de un átomo a otro), simplemente porque se requiere mucha energía para poder abrir todas las puertas y sortir.
D'un autre côté, dans un Matériau conducteur Comme un métal, les choses sont très différentes. Les atomes sont si proches les uns des autres, que leurs orbitales (les pièces) se combinent pour former une seule orbitale géante. Ce serait comme frapper tous les murs sur un sol et faire une seule salle commune pleine de lits.
Cette pièce géante serait l'équivalent du "Groupe de valence", Dans lequel les électrons sont dans leurs lits respectifs, mais tous sont dans la même pièce. En plus de former cette pièce, juste à côté, vous pouvez obtenir une large salle que les électrons peuvent utiliser pour se déplacer d'un endroit à un autre.
Il peut vous servir: Chlorure de mercure (ii): structure, propriétés, obtention, utilisationsCe grand couloir représente ce que nous appelons le "bande de conduite". Lorsque les électrons sont dans la salle, ils ne sont pas situés dans un atome particulier (ils sont démoqués) et peuvent être déplacés librement d'un endroit à un autre sans aucun problème.
Conduction électrique et théorie des bandes
Une fois que la formation de Valencia et de bandes de conduite est comprise, il est facile de comprendre pourquoi certains matériaux sont de bons conducteurs et pourquoi d'autres ne.
La clé de la conduction électrique est la difficulté de déplacer ou d'exciter les électrons trouvés dans la bande Valence dans la bande de conduite.
Cela dépend seulement de la proximité des niveaux d'énergie des deux bandes. Selon cette différence d'énergie, trois types de matériaux peuvent être distingués:
Matériaux conducteurs
Les matériaux conducteurs, tels que les métaux, sont caractérisés par Valencia et les bandes de conduite pratiquement ensemble Et presque sans différence d'énergie entre l'un et l'autre.
Cela signifie que l'excitation minimale.
Selon l'analogie susmentionnée, ce serait comme dire qu'il n'y a presque rien pour séparer la salle commune (la bande de Valence) de la salle (la bande de conduite). Pour cette raison, un électron peut facilement atteindre la salle, sans aucune porte qui empêche son passage.
 Une pièce sans murs et avec de nombreux lits, est une image similaire à la bande de valence qui se forme dans un métal. Les électrons peuvent facilement passer d'un endroit à un autre dans les couloirs, qui sont équivalents à la bande de conduite
Une pièce sans murs et avec de nombreux lits, est une image similaire à la bande de valence qui se forme dans un métal. Les électrons peuvent facilement passer d'un endroit à un autre dans les couloirs, qui sont équivalents à la bande de conduite Matériaux non conducteurs ou isolants
Qu'arrive-t-il à des matériaux tels que des plastiques ou du bois qui ne conduisent pas d'électricité? En cas de matériaux isolants, la bande de Valence et la bande de conduite ont de très grandes différences d'énergie.
Peut vous servir: calorimètreCela signifie que, afin de prendre un électron de la couche Valencia à la conduite.
Dans l'analogie du bâtiment, cela peut être vu car les électrons doivent passer par de nombreuses portes fermées pour sortir de leurs chambres dans le couloir. Ils sont littéralement piégés dans leurs atomes respectifs.
Matériaux semi-conducteurs
Entre les matériaux conducteurs et non conducteurs, nous pouvons trouver un troisième groupe de matériaux appelés semi-conducteurs.
Dans ces matériaux, les bandes de valence et de conduite ne sont pas à côté de l'autre comme dans les matériaux conducteurs, il y a donc un écart d'énergie que les électrons doivent surmonter pour pouvoir passer à la bande de conduite. Cependant, cette lacune ou cette différence d'énergie n'est pas aussi élevée que dans le cas des matériaux non conducteurs.
L'écart d'énergie entre les deux bandes ne permet pas à ces matériaux de conduire l'électricité à basse température. Cependant, lorsque la température est augmentée, l'énergie des vibrations des atomes est suffisante pour exciter certains électrons à la bande de conduite, de sorte que le matériau peut conduire l'électricité.
Comme ces matériaux sont parfois isolants et parfois ils sont des conducteurs, ils sont appelés matériaux semi-conducteurs. Quelques exemples de ce type de matériaux sont le silicium, le gallium et le sélénium.

