Types et fonctions de la protéolyse
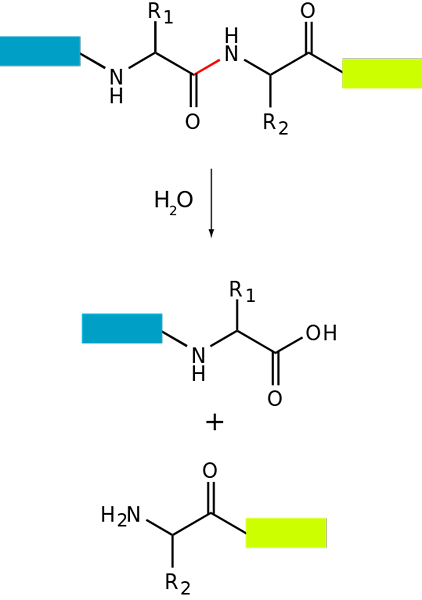
- 1492
- 202
- Prof Ines Gaillard
La Protéolyse o La dégradation des protéines est un processus par lequel une protéine cellulaire peut être complètement dégradée (même leurs acides aminés constitutifs) ou partiellement (produisant des peptides). C'est-à-dire qu'il se compose de l'hydrolyse d'un ou plusieurs des liaisons peptidiques qui maintiennent leurs acides aminés ensemble.
Ce processus peut se produire grâce à la participation d'autres protéines à activité enzymatique, dont les sites actifs l'hydrolyse des liens se produit. Il peut également se produire par des «méthodes» non enzymatiques, comme par l'action de la chaleur ou des substances avec un pH extrême (très acide ou très basique).
 Schéma de protéolyse de base d'une protéine (source: fdardel [cc by-sa (https: // createCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons)
Schéma de protéolyse de base d'une protéine (source: fdardel [cc by-sa (https: // createCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons) La dégradation des protéines se produit chez les bactéries et les animaux et les plantes, mais elle est particulièrement fréquente chez les animaux, en particulier au niveau du système digestif, car cela dépend de la digestion et de l'absorption intestinale des protéines ingérées avec le régime alimentaire.
De plus, la protéolyse est de la plus haute importance pour le maintien fonctionnel et la régulation de plusieurs processus cellulaires et a également à voir avec l'élimination des protéines qui ont la traduction, le pliage, l'emballage, l'importation, le fonctionnement, etc.
Il est important de noter qu'il s'agit d'un processus irréversible et extrêmement efficace qui fonctionne également dans la «régulation des régulateurs», car il élimine non seulement les protéines qui ont des activités biologiques «directes», mais aussi celles qui régulent d'autres protéines ou l'expression des gènes correspondants.
[TOC]
Types de protéolyse
Les protéines internes d'une cellule peuvent être dégradées de manière aléatoire ou sélective ou, ce qui est égal, contrôlé ou non. À son tour, comme mentionné précédemment, ce processus peut se produire par le biais d'enzymes spéciales ou dues à des conditions environnementales définies comme un pH acide et / ou alcalin.
Peut vous servir: tissu de revêtement épithélialIl est important de mentionner que toute protéine correctement traduite, pliée ou emballée cache une ou plusieurs séquences de signaux de dégradation qui sont "cryptiques" et qui peuvent être exposées lorsque la protéine est structurellement perturbée par la température, le pH, le pH, etc.
Protéolyse d'ubiquitination
L'ubiquitination (système d'ubiquitine-protéosome) est un système par lequel les protéines peuvent être hydrolysées sélectivement après avoir été spécifiquement marquée pour la dégradation, un processus qui peut se produire à la fois dans le cytosol et dans le noyau cellulaire.
Ce système a la capacité de reconnaître et de détruire les protéines marquées dans le noyau et dans le cytosol, ainsi que pour dégrader les protéines qui ne se plient pas correctement lors de sa translocation du cytosol au réticulum endoplasmique.
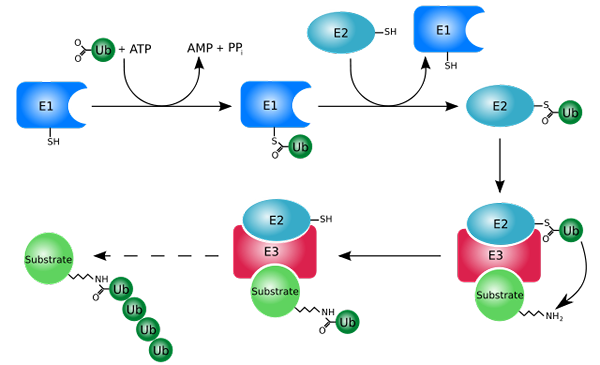 Processus de marquage avec Ubiquitinas (Ubiquitination) (Source: RogerDodd [CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)] via Wikimedia Commons)
Processus de marquage avec Ubiquitinas (Ubiquitination) (Source: RogerDodd [CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)] via Wikimedia Commons) Il fonctionne principalement en ajoutant ou en conjuguant les protéines "blanches" à une petite protéine ou peptide de 76 déchets d'acides aminés, mieux connus sous le nom d'ubiquitine. Ces protéines "marquées" par ubiquitination sont dégradées en petits fragments par le protéosome 26S, une protéase de plusieurs sous-unités.
Protéolyse d'autophagie
L'autophagie est également considérée par certains auteurs comme une forme de protéolyse, avec la distinction que cela se produit à l'intérieur d'un compartiment membranaire fermé qui est dirigé vers les lysosomes (dans les cellules animales), où les protéines contenues à l'intérieur sont dégradées par les protéases lysosomales.
Protéolyse non enzymatique
La température, le pH et même la concentration de sels d'un milieu peuvent provoquer l'hydrolyse des liaisons peptidiques qui maintiennent ensemble les acides aminés de différents types de protéines, qui se produisent par déstabilisation et interruption des liens.
Les fonctions
La protéolyse a de nombreuses fonctions dans les organismes vivants. En particulier, cela a à voir avec le remplacement des protéines.
Peut vous servir: ribosomes: caractéristiques, types, structure, fonctionsLes protéines ont une demi-vie qui varie de quelques secondes à quelques mois et les produits de leur dégradation, qu'ils soient régulés ou non, médiés par des enzymes ou non, ils sont généralement réutilisés pour la synthèse de nouvelles protéines, qui remplissent probablement différentes fonctions.
C'est ce qui se passe avec les protéines qui sont consommées avec des aliments, qui sont dégradés dans le tractus gastro-intestinal par les protéases, y compris la tripsine et la pepsine; ainsi qu'avec certaines protéines cellulaires lorsque les cellules manquent suffisamment de nourriture pour survivre.
Les systèmes protéolytiques intracellulaires détectent et éliminent les protéines "anormales" qui sont potentiellement toxiques pour les cellules, car elles peuvent interagir avec des "ligands physiologiquement inappropriés, en plus de produire des agrégats qui provoquent des obstacles mécaniques et physiques pour les processus cellulaires normaux.
L'accumulation de protéines anormales à l'intérieur de l'intérieur cellulaire, soit en raison de défauts dans le système protéolytique interne, soit pour d'autres raisons, est ce que de nombreux scientifiques considèrent comme l'une des principales causes du vieillissement dans les êtres vivants multicellulaires.
Dans le système immunitaire
La protéolyse partielle de nombreuses protéines provenant de sources exogènes ou étrangères telles que les micro-organismes envahisseurs, par exemple, est un processus fondamental pour le système de réponse immunitaire, car les lymphocytes T reconnaissent les fragments courts, le produit de la protéolyse (peptides) qui leur sont présentés en association avec l'association avec un ensemble de protéines de surface.
Ces peptides peuvent provenir du système d'ubiquitination, des processus autophagiques ou des événements de protéolyse non contrôlés.
Autres fonctions
Une autre fonction de la protéolyse limitée ou partielle est la modification des protéines nouvellement formées, qui fonctionne comme une «préparation» pour ses fonctions intra-extracellulaires. Cela est vrai, par exemple, pour certaines hormones et pour les protéines impliquées dans différents processus métaboliques.
Il peut vous servir: lymphaopoyèse: caractéristiques, étapes, régulationLa mort cellulaire programmée (apoptose) dépend également, dans une large mesure, de la protéolyse "spécifique au site", limitée ou partielle des protéines intracellulaires, qui est médiée par une cascade de protéases spécifiques appelées caspases.
Les systèmes de régulation extracellulaire dépendent également de la protéolyse spécifique au site et l'exemple le plus remarquable est celui de la coagulation sanguine.
La protéolyse générale ou complète remplit également les fonctions primaires pour la dégradation sélective de ces protéines dont la concentration doit être soigneusement contrôlée en fonction de l'état de développement physiologique, métabolique ou cellulaire.
Dans les plantes
Les plantes utilisent également des processus protéolytiques pour le contrôle de bon nombre de leurs aspects physiologiques et de développement. Il fonctionne, par exemple, dans le maintien des conditions intracellulaires et dans les mécanismes de réponse aux conditions stressantes telles que la sécheresse, la salinité, la température, entre autres.
Ainsi que chez les animaux, protéolyse dans les légumes. Dans ces organismes, la protéolyse par ubiquitination est l'une des plus importantes.
Les références
- Alberts, B., Bray, D., Hopkin, k., Johnson, un. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Biologie cellulaire essentielle. Garland Science.
- Maurizi, m. R. (1992). Proteases et protéine DeGraion chez Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, un. (2005). Dégradation régulée des protéines. Tendances des sciences biochimiques, 30 (6), 283-286.
- Vierstra, R. D. (mille neuf cent quatre vingt seize). Protéolyse chez les plantes: mécanismes et fonction. Dans le contrôle post-transcriptionnel de l'expression des gènes dans les plantes (pp. 275-302). Springer, Dordrecht.
- Loup, D. H., & Messen, R. (2018). Mécanismes de la régulation des cellules-protéolyse, la grande surprise. FEBS Letters, 592 (15), 2515-2524.
- « Caractéristiques de Paradise Ave, habitat, propriétés, reproduction, soins
- TRYPANOSOMA CRUZI Caractéristiques, cycle de vie, maladies, symptômes »

