Formules de processus isobariques, équations, expériences, exercices

- 1458
- 225
- Lucas Schneider
En un processus isobare, la pression P d'un système reste constant. Le préfixe "ISO" vient du grec et est utilisé pour désigner que quelque chose reste constant, tandis que "Baros", également du grec, signifie poids.
Les processus isobares sont propres à la fois dans des conteneurs fermés et dans des espaces ouverts, étant simples pour les localiser dans la nature. Avec cela, nous voulons dire que des changements physiques et chimiques sont possibles sur la surface terrestre ou les réactions chimiques dans des conteneurs ouverts à l'atmosphère.
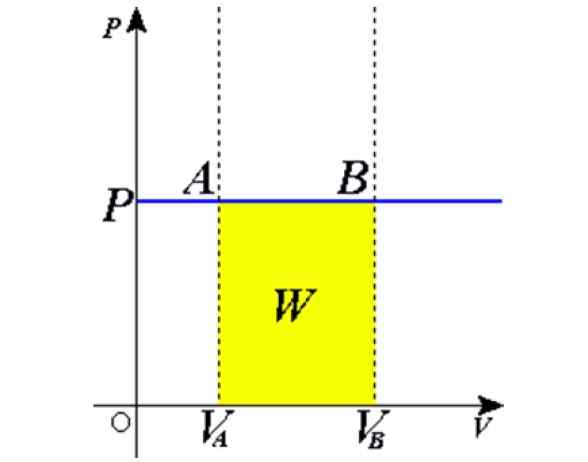 Figure 1. Processus isobare: la ligne horizontale bleue est une Isobara, ce qui signifie une pression constante. Source: Wikimedia Commons.
Figure 1. Processus isobare: la ligne horizontale bleue est une Isobara, ce qui signifie une pression constante. Source: Wikimedia Commons. Quelques exemples sont obtenus en chauffant au soleil un ballon plein d'air, de la cuisson, de l'ébullition ou de l'eau de congélation, la vapeur générée dans les chaudières ou le processus de levée d'une montgolfière. Plus tard, nous donnerons une explication de ces cas.
[TOC]
Formule et équations
Nous dérivons une équation pour le processus isobare en supposant que le système à l'étude est un gaz idéal, un modèle assez approprié pour presque tous les gaz à moins de 3 atmosphères de pression. Les particules de gaz idéales se déplacent au hasard, occupent tout le volume de l'espace qui les contient sans interagir les uns avec les autres.
Si le gaz idéal verrouillé dans un cylindre fourni avec un piston mobile est autorisé à se développer lentement, on peut supposer qu'en tout temps, ses particules sont en équilibre. Ensuite, le gaz exerce sur le piston de la zone POUR une force F Ordre de grandeur:
F = p.POUR
Où p C'est la pression de gaz. Cette force exerce un travail produisant un déplacement infinitésimal Dx Dans le piston donné par:
dw = fdx = pa.Dx
Comme le produit ADX C'est un différentiel de volume Dv, ensuite Dw = pdv. Il reste pour intégrer les deux côtés à partir du volume initial VPOUR Jusqu'au volume final VB Pour obtenir le travail total effectué par le gaz:


[TOC]
Expériences
La situation décrite est vérifiée en configurant expérimentalement un gaz dans un cylindre fourni avec un piston mobile, comme le montrent les figures 2 et 3. Un piston est placé sur le piston, dont le poids est dirigé, tandis que le gaz exerce une force grâce à la pression P qui produit sur le piston.
Il peut vous servir: Imantation: ce qui consiste, la méthode et les exemples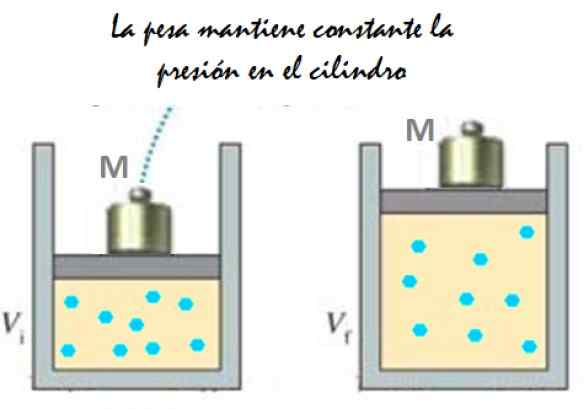 Figure 2. Expérience qui consiste à étendre un gaz de pression constant. Source: F. Zapata.
Figure 2. Expérience qui consiste à étendre un gaz de pression constant. Source: F. Zapata. Puisque le piston est capable de se déplacer librement, le volume que le gaz occupe peut changer sans problème, mais la pression reste constante. Ajout de la pression atmosphérique PAU M, qui exerce également une force, vous avez:
Mg - P.A + PAU M . A = constant
Par conséquent: p = (mg / a) + pAU M Il ne varie pas, sauf si m et avec lui le poids est modifié. Ajoutant de la chaleur au cylindre, le gaz élargira augmenter son volume ou il se contractera lors de l'extraction de la chaleur.
Processus isobariques dans le gaz idéal
L'équation d'état du gaz idéal relie les variables d'importance: pression P, volume V et température T:
P.V = n .R.T
Ici, n représente le nombre de moles et R est la constante des gaz idéaux (valides pour tous les gaz), qui est calculé en multipliant la constante de Boltzmann par le nombre d'Avogadro, résultant en:
R = 8.31 J / Mol K
Lorsque la pression est constante, l'équation d'état peut être écrite comme:
V / t = nr / p
Mais nr / p est constant, car n, r et p sont. Ainsi, lorsque le système passe d'un État 1 à un autre État 2, la proportion suivante survient, également connue sous le nom de loi de Charles:
V1/ T1 = V2/ T2
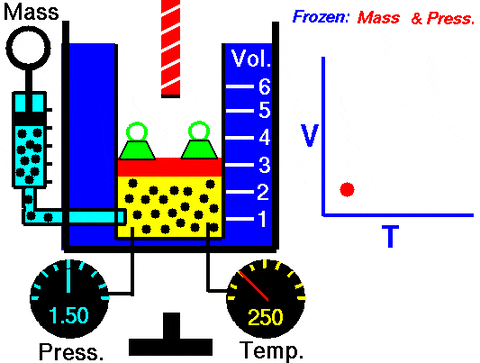 figure 3. Animation qui montre l'expansion du gaz de pression constante. À droite le graphique du volume en fonction de la température, qui est une ligne. Source: Wikimedia Commons. Glenn Research Center de la NASA [domaine public].
figure 3. Animation qui montre l'expansion du gaz de pression constante. À droite le graphique du volume en fonction de la température, qui est une ligne. Source: Wikimedia Commons. Glenn Research Center de la NASA [domaine public]. Remplacement dans W = pΔv, Le travail effectué pour passer de l'état 1 à 2, en termes de constantes et de la variation de la température, facile à mesurer avec un thermomètre:
W1 → 2 = nr (t2 - T1) = nr.Δt
D'un autre côté, la première loi de la thermodynamique établit que:
∆u = q - w
Cela signifie qu'ajoutant au gaz une certaine quantité de chaleur q, l'énergie interne ∆u augmente et les vibrations de ses molécules augmentent. De cette façon, le gaz se développe et effectue un travail en déplaçant le piston, comme nous l'avons dit auparavant.
Dans un gaz monoatomique idéal et la variation de l'énergie interne ∆U, qui comprend à la fois l'énergie cinétique et l'énergie potentielle de ses molécules, est:
∆U = (3/2)Nr Δt
Enfin, nous combinons en une des expressions que nous avons obtenues:
Q = ∆u + w = (3/2)Nr Δt + NR∆t = (5/2) Nr Δt
Alternativement, cela peut être réécrit en termes de masse m, la différence de température et une nouvelle constante appelée Chaleur de chaleur spécifique à pression constante, abrégé cp, dont les unités sont j / mol k:
Peut vous servir: Vénus (planète)Q = M Cp ∆T
Exemples
Tous les processus isobares ne sont pas effectués dans des conteneurs fermés. En fait, d'innombrables processus thermodynamiques de toutes sortes de pression atmosphérique se produisent, de sorte que les processus isobares sont de nature très fréquente. Cela comprend des changements physiques et chimiques à la surface de la Terre, des réactions chimiques dans des conteneurs ouverts et bien plus encore.
Pour que les processus isobares se produisent dans les systèmes fermés, il est nécessaire que leurs frontières soient suffisamment flexibles pour permettre des changements de volume sans varier la pression.
C'est ce qui s'est passé dans l'expérience de piston qui s'est facilement déplacé lorsque le gaz s'est étendu. La même chose se produit en enfermant un gaz dans une fête pour les fêtes ou une montgolfière.
Ici, nous avons plusieurs exemples de processus isobariques:
Faire bouillir l'eau et cuire
L'eau bouillante pour le thé ou les sauces de cuisson dans des contenants ouverts sont de bons exemples de processus isobariques, car tout le monde se développe à la pression atmosphérique.
Lors du chauffage de l'eau, de la température et du volume augmente et si la chaleur est continue, le point d'ébullition est finalement atteint, dans lequel le changement de phase d'eau se produit. Bien que cela se produise, la température reste également constante de 100 º C.
Eau de congélation
D'un autre côté, la congélation de l'eau est également un processus isobare, qu'il ait lieu dans un lac pendant l'hiver ou le réfrigérateur domestique.
Chauffer un ballon plein d'air au soleil
Un autre exemple du processus isobare est le changement du volume d'un ballon gonflé à l'air lorsqu'il est exposé au soleil. Première chose le matin, quand il ne fait pas très chaud, le globe a un certain volume.
Au fil du temps et que la température augmente, le globe chauffe également augmenter son volume et tout cela se produit sous pression constante. Le matériau du globe est un bon exemple de frontière suffisamment flexible pour faire de l'air à l'intérieur, lorsqu'il est chauffé, se dilate sans modifier la pression.
L'expérience peut également être réalisée en ajustant le globe sans infraire au sommet d'une bouteille en verre pleine avec un tiers d'eau, qui est chauffée à Maria Bio de Mary. Dès que l'eau est chauffée, le ballon est gonflé immédiatement, mais il faut prendre soin de ne pas trop chauffer pour qu'il n'explose pas.
Le ballon aérostatique
Il s'agit d'un navire flottant sans propulsion, qui utilise des courants d'air pour transporter des personnes et des objets. Le globe est généralement rempli d'air chaud, ce qui est plus froid que l'air environnant, se lève et se dilate, ce qui rend le globe rugueux.
Peut vous servir: triple pointAlors que les courants d'air directement vers le globe, il a des brûleurs qui sont activés pour chauffer le gaz lorsque vous souhaitez monter ou maintenir la hauteur, et sont désactivés en descendant ou en atterrissant. Tout cela se passe à la pression atmosphérique, supposée constante à une certaine hauteur non loin de la surface.
 Figure 4. Montgolfières. Source: Pixabay.
Figure 4. Montgolfières. Source: Pixabay. Chaudières
Dans les chaudières, la vapeur est générée en chauffant l'eau et en maintenant la pression constante. Ensuite, cette vapeur fait un travail utilisable, par exemple la production d'électricité dans les usines thermoélectriques ou agir d'autres mécanismes tels que les locomotives et les pompes à eau.
Exercices résolus
Exercice 1
Il y a 40 litres de gaz à 27 ° C. Trouvez l'augmentation du volume lors de l'ajout de chaleur isobáriquement jusqu'à ce qu'elle atteigne 100 ºC.
Solution
La loi de Charles est utilisée pour déterminer le volume final, mais l'attention: les températures doivent être exprimées à Kelvin, il suffit d'ajouter 273 K à chacun:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
A partir de:
V1/ T1 = V2/ T2 ⇒ V2 = T2(V1/ T1) = 373 ºC (40 L / 300 K) = 49.7 L
Enfin, l'augmentation du volume est V2 - V1 = 49.7 L - 40 L = 9.7 L.
Exercice 2
5 sont fournis 5.00 x 103 J de l'énergie à un gaz idéal pour faire 2.00 x 103 J de travail sur votre environnement dans un processus isobare. On demande de trouver:
a) Le changement de l'énergie interne du gaz.
b) Le changement de volume, si l'énergie interne diminue de 4.50 x 103 J et 7 sont expulsés.50 x 103 J du système, considérant une pression constante de 1.01 x 105 Pennsylvanie.
Solution à
On utilise ∆u = q - w et les valeurs données dans l'instruction sont remplacées: Q = 5.00 x 103 J et w = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Par conséquent, l'énergie interne du gaz augmente de 3.00 x 103 J.
Solution B
Le changement de volume est trouvé dans le travail effectué: W = p∆v:
∆u = q - w = q - P
La déclaration affirme que l'énergie interne diminue donc: ∆u= -4.50 x 103 J. Il nous dit également qu'une certaine quantité de chaleur est expulsée: q = -7.50 x 103 J. Dans les deux cas, le signe négatif représente une diminution et une perte: puis:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Où P = 1.01 x 105 Pennsylvanie. Comme toutes les unités sont dans le système international, le changement de volume est clair:
∆v = (-4.50 x 103 J +7.50 x 103 J) / (- 1.01 x 105 Pennsylvanie) = -2.97 x 10-2 m3
Comme le changement de volume est négatif, cela signifie que le volume a diminué, c'est-à-dire que le système a contracté.
Les références
- Byjou. Processus isobare. Récupéré de: byjus.com.
- Cengel, et. 2012. Thermodynamique. 7e édition. McGraw Hill.
- Processus xyz. En savoir plus sur le processus isobare. Récupéré de: 10 process.X y Z.
- SERAY, R., Vulle, c. 2011. Fondamentaux de la physique. 9na ed. Cengage Learning.
- Wikipédia. Lois sur le gaz. Récupéré de: est.Wikipédia.org.
- « 14 expériences psychologiques avec des humains très controversés
- Concept d'embullition, types et exemples »

