Structure de pyruvate kinase, fonction, régulation, inhibition
- 1374
- 218
- Justine Charpentier
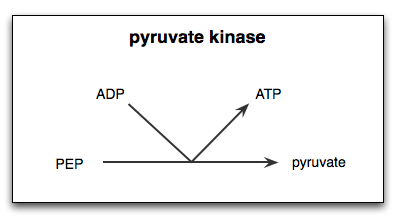
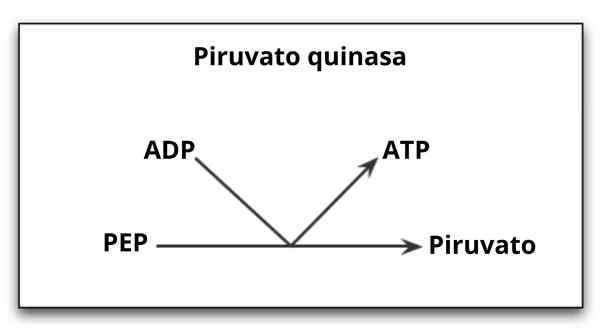 Réaction catalysée par l'enzyme pyruvato kinase
Réaction catalysée par l'enzyme pyruvato kinase Quel est le pyruvate kinase?
La Pyruvate kinase (Pyk) C'est l'enzyme qui catalyse la dernière étape de la route glycolytique, qui implique le transfert irréversible du groupe phosphate d'une molécule de phosphoenolpiruvate (PEP) vers une molécule ADP, résultant en la synthèse d'une molécule d'ATP et une autre d'acide pyruvique ou pyruvate.
Le pyruvate ainsi produit par la suite participe à diverses voies cataboliques et anaboliques (biosynthétiques): il peut être décarboxylé pour produire de l'acétyl-CoA, carboxylé pour produire de l'oxalacétate, transaminé pour produire de l'alanine, oxydé pour produire de l'acide lactique ou peut être dirigé vers la gluconoogenèse pour la synthèse de la synthèse de glucose.
Puisqu'il participe à la glycolyse, cette enzyme est de la plus haute importance pour le métabolisme des glucides de nombreux organismes, unicellulaires et multicellulaires, qui utilisent cela comme principale voie catabolique pour obtenir l'énergie.
Un exemple de cellules strictement dépendantes de la glycolyse pour obtenir de l'énergie est celle des érythrocytes de mammifères, pour lesquels une carence dans l'une des enzymes qui participent à cette voie peuvent avoir des effets considérablement négatifs.
Structure de pyruvate kinase
Chez les mammifères, quatre isoformes de l'enzyme pyruvate kinase ont été décrites:
- Pkm1, Typique dans les muscles
- Pkm2, Uniquement dans les fœtus (les deux produits du traitement alternatif du même ARN messager)
- Pkl, présent dans le foie et
- Pkr, présent dans les érythrocytes (tous deux codés par le même gène, Pklr, mais transcrit par différents promoteurs).
Cependant, l'analyse réalisée à la structure des différentes enzymes pyruvate kinase dans la nature (y compris ces 4 des mammifères) montre une grande similitude dans la structure générale, ainsi qu'en ce qui concerne l'architecture du site actif et les mécanismes de régulation.
Peut vous servir: associations coloniales: caractéristiques, types et exemplesEn général, il s'agit d'une enzyme de 200 kDa poids moléculaire, caractérisée par une structure tétramérique composée de 4 unités protéiques identiques, plus ou moins 50 ou 60 kDa, et chacune avec 4 domaines, à savoir:
- Un domaine hélicoïdal petit à l'extrémité N-terminale (absente dans les enzymes bactériennes)
- Un domaine "POUR», Identifié par une topologie de 8 tranches β pliées et 8 salles α
- Un domaine "B», Inséré entre la lame bêta pliée numéro 3 et le domaine alpha« A »
- Un domaine "C», Qui a une topologie α + β
 Structure moléculaire de l'enzyme pyruvate kinase
Structure moléculaire de l'enzyme pyruvate kinase Trois sites ont été détectés dans les tétramères du pyruvate kinase de différents organismes: le site actif, le site effecteur et le site de liaison aux acides aminés. Le site actif de ces enzymes se situe entre les domaines A et B, près du «site effecteur», qui appartient au domaine C.
Dans le Tettrámero, les domaines D forment une "petite" interface, tandis que les domaines dans une interface plus grande.
Fonction du pyruvate kinase
Comme déjà mentionné, le pyruvate kinase catalyse la dernière étape de la route glycolytique, c'est-à-dire le transfert d'un groupe phosphate du phosphoenolpiruvate (PEP) à une molécule ADP pour produire un ATP et un pyruvate ou une molécule d'acide pyruvale.
Les produits de la réaction catalysés par cette enzyme sont de la plus haute importance pour différents contextes métaboliques. Le pyruvate peut être utilisé de différentes manières:
- Dans des conditions aérobies, c'est-à-dire en présence d'oxygène, cela peut être utilisé comme substrat d'une enzyme connue sous le nom de pyruvate de déshydrogénase complémentaire, pour être décarboxylé et transformé en acétyl-CoA, une molécule qui peut entrer dans le cycle de Krebs dans les mitochondries ou participer à d'autres routes anaboliques telles que la biosynthèse des acides gras, par exemple.
- En l'absence d'oxygène ou de l'anaérobiose, le pyruvate peut être utilisé par l'enzyme lactate déshydrogénase pour produire de l'acide lactique (oxydation) par un processus appelé "fermentation lactique".
- De plus, le pyruvate peut être converti en glucose par gluconéogenèse, en alanine par la transaminase alanine, dans l'oxalacétate par le pyruvate carboxylase, etc.
Il est important de se rappeler que dans la réaction catalysée par cette enzyme, la synthèse nette de l'ATP se produit qui est comptée pour la glycolyse, produisant par chaque molécule de glucose 2 molécules de pyruvate et 2 ATP.
Ainsi, de cette perspective, le pyruvate enzymatique kinase a un rôle fondamental dans de nombreux aspects du métabolisme cellulaire, à tel point, qui est utilisé comme cible thérapeutique pour de nombreux agents pathogènes de l'être humain, parmi lesquels divers protozons se distinguent.
Régulation
Le pyruvate kinase est une enzyme extrêmement importante du point de vue du métabolisme cellulaire, car c'est celle qui forme le dernier composé résultant de la voie du catabolisme du glucose: pyruvate.
En plus d'être l'une des trois enzymes les plus régulées de toute la route glycolytique (les deux autres hexoquinase (HK) et la phosphofrunerachinase (PFK)), le pyruvate de kinase est une enzyme très importante pour le contrôle de l'écoulement métabolique et de la production d'ATP à travers glycolyse.
Il est activé par le phosphoenolpiruvate, l'un de ses substrats (régulation homotrope), ainsi que par d'autres sucres mono- et diposphorylés, bien que sa régulation dépend du type d'isoenzyme considéré.
Certains textes scientifiques suggèrent que la régulation de cette enzyme dépend également de son architecture «multidominium», car son activation semble dépendre de certaines rotations dans les domaines des sous-unités et des altérations de la géométrie du site actif.
Pour de nombreux organismes, l'activation Árostérique du pyruvate kinase dépend du fructose 1.6-biphosphate (F16bp), mais ce n'est pas vrai pour les enzymes végétales. D'autres enzymes sont également activées par l'ampli cyclique et le glucose 6-phosphate.
Peut vous servir: mains: caractéristiques, structure, fonctionsDe plus, il a été démontré que l'activité de la plupart des pyruvate kinases étudiées dépend grandement de la présence d'ions monovalents tels que le potassium (K +) et les ions divalents tels que le magnésium (Mg + 2) et le manganèse (Mn + 2).
Inhibition
Le pyruvate kinase est inhibé principalement par effecteur physiologique, donc ces processus varient considérablement entre différentes espèces et même entre les types de cellules et les tissus du même organisme.
Chez de nombreux mammifères, le glucagon, l'épinéphrine et l'AMPC ont des effets inhibiteurs sur l'activité pyruvate kinase, des effets qui peuvent être contrecarrés par l'insuline.
De plus, il a été prouvé que certains acides aminés tels que la phénylalanine peuvent avoir des actions telles que des inhibiteurs compétitifs pour cette enzyme dans le cerveau.

