Propriétés d'oxygène, structure, risques, utilisations

- 2398
- 703
- Raphaël Meyer
Il oxygène C'est un élément chimique qui est représenté par le symbole ou. C'est un gaz très réactif, qui dirige le groupe 16: les calcogens. Ce nom est dû au soufre et à l'oxygène dans presque tous les minéraux.
Sa haute électronégativité explique sa grande avidité par les électrons, ce qui conduit à se combiner avec un nombre élevé d'éléments; C'est ainsi qu'un large éventail d'oxydes minéraux se produit qui enrichissent la croûte terrestre. Ainsi, l'oxygène restant se compose et rend l'atmosphère respirante.
 L'oxygène est généralement synonyme d'air et d'eau, mais il se trouve également dans les rochers et les minéraux. Source: pxhere.
L'oxygène est généralement synonyme d'air et d'eau, mais il se trouve également dans les rochers et les minéraux. Source: pxhere. L'oxygène est le troisième élément de l'abondance de l'univers, derrière l'hydrogène et l'hélium, et est également le principal constituant de masse du cortex terrestre. Il a un pourcentage de volume de 20,8% de l'atmosphère terrestre et représente 89% de la masse d'eau.
Il a généralement deux formes allotropes: l'oxygène diatomique (ou2), qui est le moyen le plus fréquent dans la nature, et l'ozone (ou3), trouvé dans la stratosphère. Cependant, il y en a deux autres (ou4 je8) qui existent dans ses phases liquides ou solides, et sous d'énormes pressions.
L'oxygène est constamment produit par le processus de photosynthèse, effectué par des usines de phytoplancton et terrestres. Une fois produit, il est libéré pour que les êtres vivants puissent l'utiliser, tandis qu'une petite partie se dissout dans les mers, soutenant la vie aquatique.
C'est donc un élément essentiel pour les êtres vivants; Non seulement parce qu'il est présent dans la plupart des composés et molécules qui les forment, mais aussi intervenir dans tous leurs processus métaboliques.
Bien que controversé son isolement soit attribué à Carl Scheele et Joseph Priestley en 1774, il y a des indications que l'oxygène a été en fait isolé pour la première fois en 1608, par Michael Sendivogius.
Ce gaz est utilisé dans la pratique médicale pour améliorer les conditions de vie des patients souffrant de difficultés respiratoires. De même, l'oxygène est utilisé pour permettre aux gens de remplir leurs fonctions dans des environnements dans lesquels il y a une diminution ou un accès à l'oxygène atmosphérique.
L'oxygène produit commercialement est principalement utilisé dans l'industrie métallurgique pour la conversion en fer en acier.
[TOC]
Histoire
Esprit nitroarien
En 1500, Leonardo da Vinci, basé sur les expériences de Philo de Byzance. C., Il a conclu qu'une partie de l'air était consommée pendant la combustion et la respiration.
En 1608, Cornelius Drebble a montré cette salle de chauffage (nitrate d'argent, Kno3) Un gaz s'est produit. Ce gaz, comme on le serait connu plus tard, était l'oxygène; Mais Drebble n'a pas pu l'identifier comme un nouvel élément.
Puis, en 1668, John Majow a souligné qu'une partie de l'air qu'il a appelé "Spiritus nitroaerus" était responsable du feu et qu'elle a également été consommée pendant la respiration et la combustion de substances. Majow a observé que les substances ne s'arrangeaient pas en l'absence de l'esprit nitroarien.
Majoow a effectué la combustion de l'antimoine et a observé une augmentation du poids de l'antimoine pendant sa combustion. Ensuite, Majow a conclu que l'antimoine combiné avec l'esprit nitroarial.
Découverte
Bien qu'il n'ait pas reçu la reconnaissance de la communauté scientifique, dans la vie ou après sa mort, Michael Sandivogius (1604) est probablement le vrai découvreur de l'oxygène.
Sandivogius était un médecin alchimiste, philosophe et suédois qui a produit la décomposition thermique de nitrate de potassium. Ses expériences l'ont conduit à la libération d'oxygène, qu'il a appelé "Cibus vitae": la nourriture de la vie.
Entre 1771 et 1772, le chimiste suédois Carl W Scheele a réchauffé plusieurs composés: nitrate de potassium, oxyde de manganèse et oxyde de mercure. Scheele a observé qu'un gaz qui augmentait la combustion était libéré d'eux et à laquelle il a appelé "Fire Air".
Expériences de Joseph Priestly
En 1774, le chimiste anglais Joseph Joseph a réchauffé l'oxyde de mercure en utilisant une lentille d'augmentation de douze pouces qui a concentré la lumière du soleil. L'oxyde de mercure a libéré un gaz qui a fait brûler la bougie beaucoup plus rapidement que la normale.
De plus, les sacerdotaux ont testé l'effet biologique du gaz. Pour ce faire, il a placé dans un récipient fermé une souris qu'il s'attendait à survivre quinze minutes; Cependant, en présence de gaz, il a survécu à une heure, plus qu'il estimait.
Priestly a publié ses résultats en 1774; Alors que Scheele l'a fait en 1775. Pour cette raison, la découverte de l'oxygène au sacerdotal est généralement attribuée.
Oxygène dans l'air
Antoine Lavoisier, un chimiste français (1777), a découvert que l'air contient 20% d'oxygène et que lorsqu'une substance brûle, elle se combine en réalité avec de l'oxygène.
Lavoisier a conclu que le gain de poids apparent que les substances subissaient pendant la combustion était dû à la perte de poids qui se produit dans l'air; Depuis l'oxygène combiné avec ces substances et, par conséquent, les masses des réactifs ont été préservées.
Cela a permis à Lavoisier d'établir le droit de conservation de la matière. Lavoisier a suggéré le nom de l'oxygène qui provenait de la formation de racine "oxys" et "gènes". Alors l'oxygène signifie «acide ancien».
Ce nom est faux, car tous les acides ne contiennent pas d'oxygène; Par exemple, les halogénures d'hydrogène (HF, HCL, HBR et HI).
Dalton (1810) affecté à l'eau la formule chimique Ho et par conséquent, le poids atomique de l'oxygène était de 8. Un groupe de produits chimiques, dont: Davy (1812) et Berzelius (1814) ont corrigé l'approche de Dalton et ont conclu que la formule correcte de l'eau est H2O et le poids atomique de l'oxygène est 16.
Peut vous servir: eau dissionnéeProprietes physiques et chimiques
Apparence
Incroyable, toilettes et gaz insipide; Tandis que l'ozone a une odeur d'acre. L'oxygène favorise la combustion, mais en soi ce n'est pas un carburant.
 Oxygène liquide. Source: sergent d'état-major. Nika Glover, u.S. Air Force [Domaine public]
Oxygène liquide. Source: sergent d'état-major. Nika Glover, u.S. Air Force [Domaine public] Dans sa forme liquide (image supérieure), il est bleu pâle et ses cristaux sont également bleuâtre; Mais ils peuvent acquérir des tons roses, oranges et même rougeâtres (comme cela sera expliqué dans la section de leur structure).
Poids atomique
15 999 u.
Numéro atomique (z)
8.
Point de fusion
-218,79 ºC.
Point d'ébullition
-182 962 ºC.
Densité
Dans des conditions normales: 1 429 g / L. L'oxygène est un gaz le plus dense que l'air. De plus, c'est un mauvais conducteur de chaleur et d'électricité. Et à son point d'ébullition (liquide), la densité est de 1 141 g / ml.
Point triple
54 361 K et 0,1463 kPa (14,44 atm).
Point critique
154 581 K et 5 043 MPa (49770,54 ATM).
Chaleur de fusion
0,444 kJ / mol.
Chaleur de vaporisation
6,82 kJ / mol.
Capacité calorique molaire
29 378 J / (mol · k).
La pression de vapeur
À une température de 90 K, une pression de vapeur de 986,92 atm.
États d'oxydation
-2, -1, +1, +2. Le statut d'oxydation le plus important est -2 (ou2-).
Électronégativité
3.44 sur l'échelle Pauling
Énergie d'ionisation
Premièrement: 1.313.9 kJ / mol.
Deuxième: 3.388,3 kJ / mol.
Troisième: 5.300,5 kJ / mol.
Ordre magnétique
Paramagnétique.
Solubilité dans l'eau
La solubilité en oxygène dans l'eau diminue à mesure que la température augmente. Par exemple: 14,6 ml d'oxygène / L d'eau sont dissous à 0 ºC et 7,6 ml d'oxygène / L d'eau à 20 ºC. La solubilité de l'oxygène dans l'eau potable est supérieure à celle de l'eau de mer.
Dans la température de 25 ºC et à une pression de 101,3 kPa, l'eau potable peut contenir 6,04 ml d'oxygène / L d'eau; Tandis que l'eau de mer seulement 4,95 ml d'oxygène / L d'eau.
Réactivité
L'oxygène est un gaz hautement réactif qui réagit directement avec presque tous les éléments à température ambiante et des températures élevées; Sauf pour les métaux avec des potentiels de réduction plus élevés que le cuivre.
Vous pouvez également réagir avec les composés, oxydant les éléments présents en eux. C'est ce qui se passe lorsqu'il réagit avec le glucose, par exemple, pour produire de l'eau et du dioxyde de carbone; ou lorsque le bois ou un hydrocarbure brûle.
L'oxygène peut accepter les électrons par transfert complet ou partiel, il est donc considéré comme un agent oxydant.
Le numéro d'oxydation le plus courant ou l'état d'oxydation est -2. Avec ce numéro d'oxydation, il se trouve dans l'eau (h2O), dioxyde de soufre (donc2) et le dioxyde de carbone (CO2).
De plus, dans des composés organiques tels que les aldéhydes, les alcools, les acides carboxyliques; acides communs comme h2Swin4, H2CO3, HNO3; et dans ses sels dérivés: na2Swin4, N / A2CO3 OK Non3. Dans chacun d'eux, l'existence de l'O pourrait être supposée2- (ce qui n'est pas vrai pour les composés organiques).
Oxydes
L'oxygène est présent comme ou2- Dans les structures cristallines des oxydes métalliques.
D'un autre côté, dans les superoxydes métalliques, comme le superoxyde de potassium (KO2), l'oxygène est comme l'ion ou2-. Pendant son séjour dans des peroxydes métalliques, pour dire du peroxyde de baryum (Bao2), l'oxygène est présenté comme l'ion ou22- (Ba2+SOIT22-).
Isotopes
L'oxygène a trois isotopes stables: 16Ou, avec une abondance de 99,76%; il 17Ou, avec 0,04%; et le 18Ou, avec 0,20%. Notez que il 16Ou c'est de loin l'isotope le plus stable et le plus abondant.
Structure et configuration électroniques
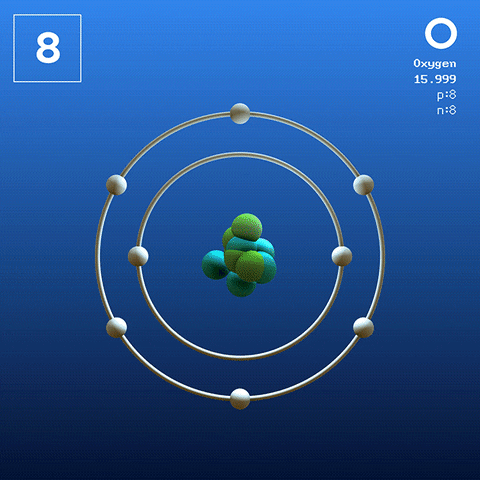
Molécule d'oxygène et interactions
 Molécule d'oxygène diatomique. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Molécule d'oxygène diatomique. Source: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'oxygène dans son état basal est un atome dont la configuration électronique est:
[Il] 2s2 2 P4
Selon la théorie de la liaison Valencia (TEV), deux atomes d'oxygène sont liés de manière covalente de sorte que les deux complètent séparément leur octet de Valence; En plus de pouvoir accoupler leurs deux électrons solitaires des Orbitals 2P.
De cette façon, la molécule diatomique d'oxygène apparaît, ou2 (Image supérieure), qui a une double liaison (o = o). Sa stabilité énergétique est telle que l'oxygène ne se trouve jamais comme des atomes individuels dans la phase gazeuse mais comme des molécules.
Parce que le o2 Il est homonucléaire, linéaire et symétrique, manque de moment dipolaire permanent; Par conséquent, ses interactions intermoléculaires dépendent de sa masse moléculaire et des forces de dispersion de Londres. Ces forces sont relativement faibles pour l'oxygène, ce qui explique pourquoi il s'agit d'un gaz dans des conditions terrestres.
Cependant, lorsque la température baisse ou augmente la pression, les molécules ou2 Ils sont obligés de cohérent; au point que leurs interactions deviennent significatives et permettent la formation de liquide ou d'oxygène solide. Pour essayer de les comprendre moléculairement, il faut ne pas perdre de vue le o2 comme unité structurelle.
Ozone
L'oxygène peut adopter d'autres structures moléculaires considérablement stables; C'est-à-dire qu'il se trouve dans la nature (ou au sein du laboratoire) sous diverses formes allotropes. L'ozone (image inférieure), ou3, Par exemple, c'est la deuxième alotrope de l'oxygène le plus connu.
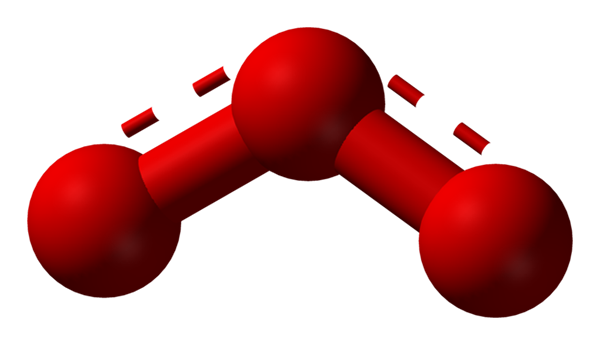 Structure de l'hybride de résonance représenté par un modèle de sphères et de barres pour la molécule d'ozone. Source: Ben Mills via Wikipedia.
Structure de l'hybride de résonance représenté par un modèle de sphères et de barres pour la molécule d'ozone. Source: Ben Mills via Wikipedia. Encore une fois, le TEV tient, explique et démontre que dans le ou3 Il doit y avoir des structures de résonance qui stabilisent la charge formelle positive de l'oxygène central (lignes parsemées en rouge); Tandis que l'oxygène de la fin du boomerang, une charge négative est distribuée, provoquant la charge totale de l'ozone.
Peut vous servir: règles de solubilité: aspects et règles généralesDe cette façon, les liens ne sont pas simples, mais pas doubles. Des exemples d'hybrides de résonance sont très courants dans autant de molécules ou d'ions inorganiques.
Le o2 je3, En conséquence, que leurs structures moléculaires sont différentes, il en va de même pour leurs propriétés physiques et chimiques, des phases liquides ou cristallines (même si les deux consomment des atomes d'oxygène). Ils théorisent que la synthèse à grande échelle d'ozone cyclique est probable, dont la structure ressemble à celle d'un triangle rougeâtre et oxygéné.
Jusqu'à présent, les "alotropes normaux" de l'oxygène arrivent. Cependant, il y en a deux autres à considérer: o4 je8, trouvé ou proposé dans le liquide et l'oxygène solide, respectivement.
Oxygène liquide
L'oxygène gazeux est incolore, mais lorsque la température descend à -183 ºC, se condense dans un liquide bleu pâle (céleste similaire). Interactions entre les molécules ou2 C'est maintenant que même leurs électrons peuvent absorber les photons dans la région rouge du spectre visible pour refléter sa couleur bleue caractéristique.
Cependant, il a été théorisé que dans ce liquide, il y a plus que des molécules simples ou2, mais aussi une molécule ou4 (Image inférieure). Il semble que l'ozone avait "coincé" un autre atome d'oxygène qui intercéde en quelque sorte par la charge formelle nouvellement décrite.
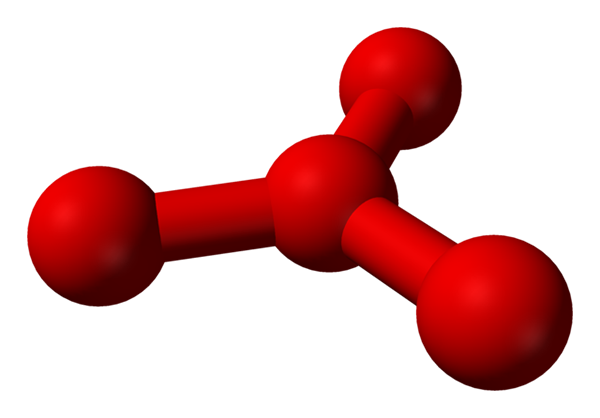 Modèle Structure proposée avec des sphères et des barres pour la molécule de tétraoxygène. Source: Benjah-Bmm27 [domaine public]
Modèle Structure proposée avec des sphères et des barres pour la molécule de tétraoxygène. Source: Benjah-Bmm27 [domaine public] Le problème est que selon les simulations informatiques et moléculaires, cette structure pour le O4 Ce n'est pas précisément stable; Cependant, ils prédisent qu'ils existent en tant qu'unités (ou2)2, c'est-à-dire deux molécules de o2 Ils s'approchent tellement qu'ils forment une sorte de cadre irrégulier (les atomes ou ne sont pas alignés les uns avec les autres).
Oxygène solide
Une fois que la température descend à -218,79 ºC, l'oxygène cristallise dans une structure cubique simple (phase γ). Au fur et à mesure que la température baisse encore plus, le verre cube subit des transitions vers les phases β (Rhomboédica et à -229,35 ºC) et α (monoclinique et à -249,35 ºC).
Toutes ces phases cristallines d'oxygène solide se produisent à la pression ambiante (1 atm). Lorsque la pression augmente à 9 GPa (~ 9000 atm), la phase Δ apparaît, dont les cristaux sont orange. Si la pression continue d'augmenter à 10 GPa, l'oxygène solide rouge apparaît ou la phase ε (encore monoclinique).
La phase ε est spéciale car la pression est si énorme que les molécules ou2 Non seulement ils sont hébergés comme des unités ou4, mais aussi ou8:
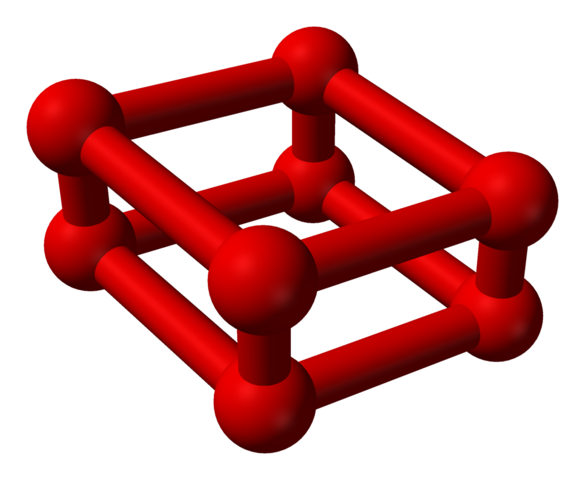 Structure du modèle avec des sphères et des barres pour la molécule d'octaoxygène. Source: Benjah-Bmm27 [domaine public]
Structure du modèle avec des sphères et des barres pour la molécule d'octaoxygène. Source: Benjah-Bmm27 [domaine public] Notez que ceci ou8 Il se compose de deux unités ou4 où le cadre irrégulier a déjà expliqué. Il est également valable de le considérer comme quatre ou2 étroitement aligné et en position verticale. Cependant, sa stabilité est telle sous cette pression que le ou4 je8 Ce sont deux alotropes supplémentaires pour l'oxygène.
Et enfin nous avons la phase ζ, métallique (à des pressions supérieures à 96 GPa), dans laquelle la pression rend les électrons dispersés dans le verre; Comme avec les métaux.
Où est et la production
Minéraux
L'oxygène est en masse le troisième élément de l'univers, derrière l'hydrogène et l'hélium. Il constitue l'élément le plus abondant de la croûte de la Terre, représentant environ 50% de sa masse. Il est principalement combiné avec le silicium, sous forme d'oxyde de silicium (SIO2).
L'oxygène fait partie d'innombrables minéraux. De même, il est situé dans le cadre de nombreux composés tels que les carbonates, les phosphates, les sulfates, les nitrates, etc.
Air
L'oxygène représente 20,8% de l'air atmosphérique en volume. Dans la troposphère, c'est principalement comme une molécule d'oxygène diatomique. Pendant que dans la stratosphère, une couche gazeuse entre 15 et 50 km de la surface de la Terre, est comme l'ozone.
L'ozone est produit par un choc électrique sur la molécule de O2. Cet alotrope d'oxygène absorbe la lumière ultraviolette du rayonnement solaire, bloquant son action nocive sur les humains, qui dans les cas extrêmes est associé à l'apparition de mélanomes.
Eau fraîche et salée
L'oxygène est un élément principal de l'eau de mer et de l'eau douce des lacs, des rivières et des eaux souterraines. L'oxygène fait partie de la formule chimique de l'eau, massant 89%.
D'un autre côté, bien que la solubilité de l'oxygène dans l'eau soit relativement faible, la quantité d'oxygène dissous dans ceci est essentielle pour la vie aquatique, qui comprend de nombreuses espèces d'animaux et d'algues.
Êtres vivants
L'être humain est formé, environ 60% de l'eau et en même temps, riche en oxygène. Mais en outre, l'oxygène fait partie de nombreux composés, tels que les phosphates, les carbonates, les acides carboxyliques, les cétones, etc., qui sont essentiels pour la vie.
L'oxygène est également présent dans les polysaccharides, les lipides, les protéines et les acides nucléiques; c'est-à-dire les macromolécules biologiques si appelées.
Il fait également partie du gaspillage nocif de l'activité de l'homme, par exemple: dioxyde de carbone et dioxyde, ainsi que le dioxyde de soufre.
Production biologique
 Les plantes sont responsables de l'enrichissement de l'air d'oxygène en échange d'un dioxyde de carbone que nous expirons. Source: Pexels.
Les plantes sont responsables de l'enrichissement de l'air d'oxygène en échange d'un dioxyde de carbone que nous expirons. Source: Pexels. L'oxygène se produit pendant la photosynthèse, un processus par lequel le phytoplancton marin et les plantes terrestres utilisent l'énergie lumineuse pour réagir le dioxyde de carbone avec de l'eau, provoquant du glucose et libérant de l'oxygène.
On estime que plus de 55% de l'oxygène produit par la photosynthèse est dû à l'action du phytoplancton marin. Par conséquent, il constitue la principale source de génération d'oxygène sur Terre et est responsable du maintien de la vie.
Production industrielle
Liquéfaction aérienne
La principale méthode de production industrielle de l'oxygène est créée en 1895, indépendamment par Karl Paul Gottfried von Linde et William Hamson. Cette méthode utilise actuellement certaines modifications.
Peut vous servir: butanone: structure, propriétés et utilisationsLe processus commence par la compression de l'air pour condenser la vapeur d'eau et l'éliminer ainsi. Ensuite, l'air est tamisé lorsqu'il est conduit par un mélange de zéolite et de gel de silice, pour l'élimination du dioxyde de carbone, des hydrocarbures lourds et le reste de l'eau.
Par la suite, les composants de l'air liquide sont séparés par une distillation fractionnaire, atteignant la séparation des gaz présents dans ses différents points d'ébullition. Par cette méthode, l'oxygène est obtenu avec une pureté à 99%.
Électrolyse de l'eau
L'oxygène est produit par une électrolyse d'eau hautement purifiée et avec une conductivité électrique qui ne dépasse pas 1 µs / cm. L'eau est séparée par électrolyse dans ses composants. L'hydrogène comme cation se déplace vers la cathode (-); Tandis que l'oxygène se déplace vers l'anode (+).
Les électrodes ont une structure spéciale pour collecter les gaz et produire par la suite leur liquéfaction.
Décomposition thermique
La décomposition thermique de composés tels que l'oxyde de mercure et l'hôte (nitrate de potassium), libère l'oxygène, qui peut être collecté pour une utilisation. Les peroxydes sont également utilisés à cet effet.
Papier biologique
L'oxygène est produit par le phytoplancton et les plantes terrestres à travers la photosynthèse. Il traverse la paroi pulmonaire et dans le sang, il est capturé par l'hémoglobine, qui le transporte vers différents organes puis utilisé dans le métabolisme cellulaire.
Dans ce processus.
La respiration peut schématiser comme suit:
C6H12SOIT6 + SOIT2 => CO2 + H2Ou + énergie
Le glucose est métabolisé dans un ensemble de processus chimiques séquentiels, qui comprend la glycolyse, le cycle de Krebs, la chaîne de transport électronique et la phosphorylation oxydative. Cette série d'événements produit de l'énergie qui s'accumule sous forme d'ATP (adenosín triposphate).
L'ATP est utilisé dans divers processus dans les cellules qui comprend le transport d'ions et d'autres substances à travers la membrane plasmique; l'absorption intestinale des substances; la contraction de différentes cellules musculaires; Le métabolisme de différentes molécules, etc.
Les leucocytes polymorphonucléaires et macrophages sont des cellules phagocytaires capables d'utiliser de l'oxygène pour produire des ions superoxyde, du peroxyde d'hydrogène et de l'oxygène unique, qui sont utilisés pour détruire les micro-organismes.
Des risques
La respiration de l'oxygène à des pressions élevées peut provoquer des nausées, des étourdissements, des spasmes musculaires, une perte de vision, des convulsions et une perte de conscience. De plus, la respiration de l'oxygène pur pendant une longue période provoque une irritation pulmonaire, manifestée par la toux et un raccourcissement de la respiration.
Cela peut également être la cause de la formation d'un œdème pulmonaire: une condition très grave qui limite la fonction respiratoire.
Une atmosphère à forte concentration en oxygène peut être dangereuse, car elle facilite le développement des incendies et des explosions.
Applications
Médecins
L'oxygène est administré aux patients atteints d'insuffisance respiratoire; C'est le cas des patients atteints de pneumonie, d'œdème pulmonaire ou d'emphysème. Ils ne pouvaient pas respirer l'oxygène environnemental car ils seraient gravement affectés.
Les patients souffrant d'insuffisance cardiaque dans ce qui est présenté à l'accumulation de liquide dans les alvéoles a également besoin d'oxygène pour être fourni; Comme les patients qui ont subi un grave accident vasculaire (AVC).
Besoin professionnel
Les pompiers qui combattent un incendie dans un environnement avec une ventilation inappropriée, nécessitent l'utilisation de masques et de bouteille d'oxygène qui leur permettent de remplir leurs fonctions, sans mettre leur vie à des risques plus importants.
Les sous-marins sont équipés d'un équipement de production d'oxygène qui permet aux marins de rester dans un environnement fermé sans accès à l'air atmosphérique.
Les plongeurs font leur travail immergé dans l'eau et, par conséquent, isolé de l'air atmosphérique. Ils respirent par l'oxygène pompé par des tubes connectés à leur scan ou à l'utilisation de bombones attachés au corps du sous-marin.
Les astronautes mettent leurs activités dans des environnements équipés de générateurs d'oxygène qui permettent la survie pendant les voyages spatiaux et dans une station spatiale.
Industriel
Plus de 50% de l'oxygène produit industriellement est consommé dans la transformation du fer en acier. La fonte est injectée avec un jet d'oxygène afin d'éliminer le soufre et le carbone présent; réagir pour produire des gaz si2 et Cie2, respectivement.
L'acétylène est utilisé en combinaison avec de l'oxygène pour couper des plaques métalliques et également pour produire son soudage. L'oxygène est également utilisé dans la production de verre, augmentant la combustion dans sa cuisson pour améliorer sa transparence.
Spectrophotométrie d'absorption atomique
La combinaison d'acétylène et d'oxygène est utilisée pour brûler des échantillons d'origine dans un spectrophotomètre d'absorption atomique.
Pendant la procédure, un faisceau de lumière d'une lampe est influencé par la flamme, qui est spécifique à l'élément souhaité pour quantifier. La flamme absorbe la lumière de la lampe, permettant la quantification de l'élément.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Oxygène. Récupéré de: dans.Wikipédia.org
- Richard Van Noordden. (13 septembre 2006). Juste une jolie phase? Oxygène rouge solide: inutile mais délicieux. Récupéré de: Nature.com
- Azonano. (4 décembre 2006). Strupture de cristal en phase E solide en oxygène déterminé le long des découvrements d'un cluster O8 oxygène. Récupéré de: Azonano.com
- Centre national d'information sur la biotechnologie. (2019). Molécule d'oxygène. Base de données PubChem. CID = 977. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Docteur. Doug Stewart. (2019). Faits d'élément d'oxygène. Chimicool. Récupéré de: Chemicool.com
- Robert C. Effronté. (9 juillet 2019). Oxygène: élément chimique. Encyclopædia Britannica. Récupéré de: Britannica.com
- Enfants wiki. (2019). Famille d'oxygène: propriétés des éléments via. Récupéré de: simplement.Science
- Advameg, Inc. (2019). Oxygène. Récupéré de: Madehow.com
- Lentech b.V. (2019). Tableau d'époque: oxygène. Récupéré de: lentech.com
- Département de la santé et des services aux personnes âgées du New Jersey. (2007). Oxygène: Fiche d'information sur les substances dangereuses. [PDF]. Récupéré de: NJ.Gouvernement
- Yamel Mattarollo. (26 août 2015). Applications industrielles à oxygène industriel. Récupéré de: altecsty.com
- « Historique des néons, propriétés, structure, risques, utilisations
- Caractéristiques de l'histidine, structure, fonctions, nourriture »

