Oxácido

- 4643
- 1375
- Anaïs Julien
 Molécule d'acide pertectaletique, un oxo acide très rare de Tecnecio. Source: Jynto, Wikimedia Commons
Molécule d'acide pertectaletique, un oxo acide très rare de Tecnecio. Source: Jynto, Wikimedia Commons Qu'est-ce qu'un oxacide?
UN oxácido, U oxoacide, c'est un acide qui contient de l'oxygène. Il est composé d'hydrogène, d'oxygène et d'un élément non métallique qui constitue l'atome central si appelé. En fonction du nombre d'atomes d'oxygène, et par conséquent, les états d'oxydation de l'élément non métallique peuvent former plusieurs oxacides.
Les oxcacides ont un grand nombre d'utilisations, qui sont difficiles à décrire en général. Son application dépendra considérablement de l'atome central et du nombre d'oxygène.
Ils peuvent servir à partir de composés pour la synthèse des matériaux, des engrais et des explosifs, même à des fins analytiques ou la production de boissons gazeuses, comme cela se produit avec de l'acide carbonique et de l'acide phosphorique, H3Pote4, Faire partie de la composition de ces boissons.
Caractéristiques et propriétés de l'oxcacide
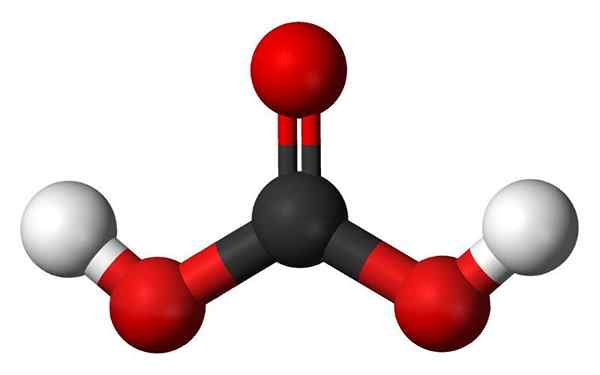 Molécule d'acide carbonique. Source: Jynto et Ben Mills, Wikimedia Commons
Molécule d'acide carbonique. Source: Jynto et Ben Mills, Wikimedia Commons - Groupes hydroxyles: L'une des principales caractéristiques d'un oxácido est non seulement qu'elle a de l'oxygène, mais c'est aussi comme un groupe OH. D'un autre côté, certains oxacides ont ce qu'on appelle un groupe oxo, e = o. Dans le cas de l'acide phosphoreux, il a un groupe oxo, p = o. Ils manquent d'atomes H, donc "ils ne sont pas responsables" de l'acidité.
- Atome central: L'atome central (E) peut ou non être un élément électronégatif, selon son emplacement dans le bloc P du tableau périodique. D'un autre côté, l'oxygène, un élément légèrement plus électronégatif que l'azote, attire les électrons de la liaison OH, permettant ainsi la libération de l'ion h+. E est donc lié aux groupes OH. Quand un ion h est libéré+ L'ionisation acide se produit, c'est-à-dire qu'elle acquiert une charge électrique, ce qui, dans son cas, est négatif. Un oxcacide peut libérer autant d'ions H+ Comme les groupes OH ont dans sa structure, et plus il y en a, plus la charge négative sera grande.
- Force acide: La force de presque tous les oxacides qui ont le même atome central (pas de métal), augmente avec l'augmentation de l'état d'oxydation de l'élément central, qui à son tour est directement lié à l'augmentation du nombre d'atomes d'oxygène.
Par exemple, trois séries oxacides sont montrées dont les forces d'acidité sont commandées du moins au plus grand:
H2Swin3 < H2Swin4
HNO2 < HNO3
Hclo < HClO2 < HClO3 < HClO4
Dans la plupart des oxacides qui ont des éléments différents avec le même état d'oxydation, mais appartenant au même groupe du tableau périodique, la force d'acidité augmente directement avec l'électronégativité de l'atome central:
H2Référencement3 < H2Swin3
H3Pote4 < HNO3
HBRO4 < HClO4
Formation d'Oxcacide
Comme mentionné au début, les oxácidos sont générés lorsque certaines substances, appelées oxydes acides, réagissent avec l'eau. Cela sera expliqué en utilisant le même exemple d'acide carbonique.
Co₂ + h₂o h2CO3
Oxyde acide + eau => oxácido
Ce qui se passe, c'est que la molécule de H₂o se lie de manière covalente à celle de Co₂. Si l'eau est éliminée par la chaleur, l'équilibre à la régénération du CO₂ se déplace, c'est-à-dire qu'une boisson à soude chaude perdra bientôt sa sensation effervescente qu'un rhume.
D'un autre côté, des oxydes acides se forment lorsqu'un élément non métallique réagit avec l'eau, bien que, plus précisément, lorsque l'élément de réaction forme un oxyde avec un caractère covalent, dont la solution dans l'eau génère des ions HEES+.
Il a déjà été dit que les ions h+ Ils sont le produit de l'ionisation oxacide résultante.
Exemples de formation
L'oxyde chlorique, Cl2SOIT5, Réagissez avec l'eau pour donner l'acide chlorique:
CL2SOIT5 + H₂o => hclo3
Oxyde sulfurique, donc3, Réagit avec l'eau pour former de l'acide sulfurique:
Swin3 + H₂o => h2Swin4
Et l'oxyde périódique, je2SOIT7, réagit avec l'eau pour former l'acide périódique:
Toi2SOIT7 + H₂o => Hio4
En plus de ces mécanismes classiques pour la formation de l'oxacide, il y a d'autres réactions dans le même but.
Peut vous servir: réaction endothermiquePar exemple, le trichlorure de phosphore, PCL3, Il réagit avec l'eau pour produire de l'acide phosphoreux, un oxácido et de l'acide chlorhydrique, un acide halohydrique.
PCL3 + 3h2O => H3Pote3 + HCL
Et phosphore pentachlorure, PCL5, réagit avec l'eau pour donner de l'acide phosphorique et de l'acide chlorhydrique.
PCL5 + 4 H₂o => H3Pote4 + HCL
Oxcacides métalliques
Certains métaux de transition forment des oxydes acides, c'est-à-dire qu'ils se dissolvent dans l'eau pour donner des oxacides.
Oxyde de manganèse (VII) (anhydrum permanganique)2SOIT7 Et l'oxyde de chrome (VI) sont les exemples les plus courants.
MN2SOIT7 + H₂o => hmno4 (acide permanganique)
Cro3 + H₂o => h2Cro4 (acide chromique)
Nomenclature
Calcul de Valence
Pour nommer correctement un oxácid. À partir de la formule générique Heo, ce qui suit est considéré:
- Le O a Valencia -2.
- Le Valence de los h es +1.
Dans cet esprit, l'Oxácid. Ainsi, vous avez la somme algébrique suivante:
-2 + 1 + e = 0
E = 1
Par conséquent, E est +1 Valence.
Puis les valences possibles qui peuvent avoir et. Si parmi leurs valences sont des valeurs +1, +3 et +4, puis "travailler" avec son mineur Valence.
Nommez l'acide
Pour nommer Heo commence par l'appeler acide, suivi du nom de E avec les suffixes -ico, si vous travaillez avec le plus grand Valence, ou -ono, si vous travaillez avec le mineur. Lorsqu'il y a trois ou plus, les hypo-prefixes sont utilisés pour se référer au mineur et plus grand des valences.
Ainsi, Heo serait appelé:
Acide hoquet(Nom de E)ours
Puisque +1 est le moindre de ses trois valences. Et si c'était Heo2, Ensuite, j'aurais Valencia +3 et il serait appelé:
Il peut vous servir: diphénylamineAcide (e)ours
Et de la même manière pour Heo3, Avec E travaillant avec Valencia +5:
Acide (e)ICO
Exemples
- Acide cromique (h2Croisement2SOIT4). C'est un acide fort et instable à des températures élevées.
- Acide dicromique (h2Croisement2SOIT7). Sa présence est perceptible dans les mélanges d'acides chromiques utilisés pour nettoyer le verre.
- Acide hypochlouleux (HCLO). Réparez rapidement les tissus cutanés.
- Acide bromous (HBRO2). C'est un composé intermédiaire et instable. Composé de bromo.
- Acide orthophosphorique (h3Pote4). Acide irritant pour la peau non carrée.
- Acide permanganique (HMNO4). Acide très fort.
- Acide périódique (Hio4). En chimie organique, il est utilisé pour analyser les structures d'autres molécules.
- Acide bromique (HBRO3). Oxcacide de brome. Ses sels s'oxydent puissamment.
- Acide hypobrome (HBRO). Il est utilisé dans une solution aqueuse diluée et est obtenu par réaction entre l'eau et le BR2.
- Acide métaphosphorique (HPO3). Très corrosif, incolore et solide aux toilettes à température ambiante.
- Acide yodium (Hio3). Réactif utilisé pour détecter la morphine dans un produit.
- Acide de soufre (H2Swin3). Provoquant des pluies acides.
- Acide sulfurique (h2Swin4). Régulièrement pour le traitement des métaux et les engrais, c'est l'un des composés chimiques les plus utilisés.
- Acide nitrique (HNO3). Réactif de laboratoire, très dangereux car il peut brûler la peau.
- Acide chlorique (HCLO3). En décomposant, il produit beaucoup de produits. Il est à froid à une concentration de 30%.
- Acide arsenioso (h3ASO3). Contient de l'arsenic et est très toxique et cancérigène. Il est utilisé dans les herbicides et les pesticides.
- Acide ortosilic (h4Sio4). Acid faible utilisé comme agent de soutien ou de dessicant.
- Acide carbonique (h2CO3). Il est utilisé pour faire des boissons gazeuses.
- Acide nitreux (HNO2). En solution, il est remarquablement dissocié.
- Acide métaborique (HBO2). Solide blanc cristallin légèrement soluble solide.
Les références
- Composés oxoacides communs. Récupéré de Thoughtco.com.

