Propriétés d'oxalate de calcium (CAC2O4), structure, utilisations, risques
- 3400
- 411
- Prof Ines Gaillard
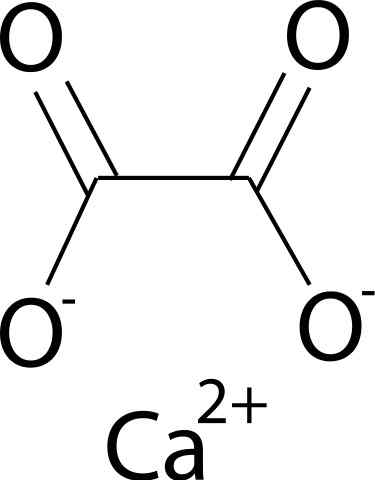
Il Oxalate de calcium Il s'agit d'un composé organique formé par des éléments de carbone (C), d'oxygène (O) et de calcium (CA) (CA) (CA). Sa formule chimique est CAC2SOIT4. Il se trouve généralement dans ses trois formes hydratées: mono-, di- et trihydraté. C'est, avec une, deux ou trois molécules d'eau respectivement dans sa structure cristalline.
L'oxalate de calcium se trouve dans les minéraux, les plantes, les champignons et d'autres êtres vivants tels que les mammifères et même chez les êtres humains à la suite du métabolisme de certaines protéines. Il peut être trouvé dans l'urine des humains et de certains animaux.
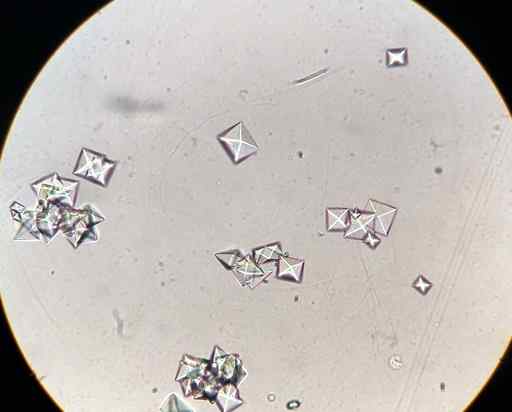 Cristaux d'oxalate de calcium CAC2SOIT4 Dans un échantillon d'urine observé au microscope. J3D3 / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Cristaux d'oxalate de calcium CAC2SOIT4 Dans un échantillon d'urine observé au microscope. J3D3 / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Certains aliments comme les épinards, les ruibarbos, le soja.
Vous pouvez éviter l'apparence de pierres de cac2SOIT4 Dans les reins, si de nombreux liquides sont ingérés, en particulier l'eau, en évitant les aliments à forte teneur en oxalate et en consommant ceux riches en calcium et en magnésium.
L'oxalate de calcium forme des incrustations indésirables dans les tuyaux et les réservoirs de processus tels que la fabrication de pâte et de papier, ainsi que dans les usines de bière.
[TOC]
Structure
L'oxalate de calcium est formé par le Ca ion de calcium2+ et l'ion oxalate c2SOIT42-. L'anion oxalate se compose de deux atomes de carbone et de quatre atomes d'oxygène. Les charges négatives d'anion oxalate se trouvent dans les atomes d'oxygène.
 Structure chimique de l'oxalate de calcium. Vsimonian / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons.
Structure chimique de l'oxalate de calcium. Vsimonian / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons. Nomenclature
- Oxalate de calcium
- Sel de calcium d'acide oxalique
- Sel de calcium d'acide étanodiologique
Propriétés
État physique
Cristallin incolore, blanc, jaune ou brun qui peut être sous trois formes hydratées différentes.
Poids moléculaire
128,1 g / mol
Point de fusion
Le monohydrate d'oxalate de calcium se décompose à 200 ° C.
Poids spécifique
CAC monohydrate2SOIT4 •H2O = 2,22 g / cm3
CAC dihydrate2SOIT4 •2h2O = 1,94 g / cm3
Trihydrate de CAC2SOIT4 •3h2O = 1,87 g / cm3
Solubilité
Presque insoluble dans l'eau: 0,00061 g / 100 g d'eau à 20 ° C. Monohydraté se dissout dans l'acide dilué.
pH
Les solutions aqueuses d'oxalate de calcium sont faiblement basiques.
Propriétés chimiques
L'oxalate de calcium est le sel de calcium de l'acide oxalique. Il s'agit d'un produit secondaire naturel du métabolisme, il est donc très abondant dans le corps humain et fait partie de nombreux aliments.
L'acide oxalique et sa base conjuguée, l'oxalate, sont des composés organiques très oxydés, avec une puissante activité chélatante, c'est-à-dire qu'ils peuvent être facilement combinés avec des ions positifs avec des charges +2 ou +3.
Peut vous servir: groupe méthyl ou metiloSes solutions aqueuses sont faiblement basiques car l'ion oxalate a tendance à prendre des protons H+ de l'eau, qui libère des ions oh-. Après avoir pris deux protons H+ L'ion oxalate devient l'acide oxalique H2C2SOIT4:
C2SOIT42- + H2O → HC2SOIT4- + Oh-
HC2SOIT4- + H2O → H2C2SOIT4 + Oh-
Présence dans la nature
En minéraux
L'oxalate de calcium est l'oxalate le plus courant et est présenté sous la forme de minéraux appelés Whewellita, Weddellita et Caoxite.
Whewellita est le cac monohydraté2SOIT4 •H2Ou et est la plus stable des formes de ce composé.
 Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Le weddellita est le cac dihydrate2SOIT4 •2h2O et est moins stable que monohydraté.
 Cristaux minéraux Weddelite. Leon Hupperichs / CC par (https: // CreativeCommons.Org / licences / par / 3.0). Source: Wikimedia Commons.
Cristaux minéraux Weddelite. Leon Hupperichs / CC par (https: // CreativeCommons.Org / licences / par / 3.0). Source: Wikimedia Commons. Caxita est le calcium oxalate trihydrado cac2SOIT4 •3h2SOIT.
Dans les plantes et les champignons
L'oxalate de calcium est associé aux sols et aux feuilles secs, également avec des agents pathogènes, des libres, une symbiose ou des plantes associées aux plantes. Dans ce dernier, les cristaux se forment par la précipitation du calcium sous la forme de son oxalate.
CAC Formation2SOIT4 Pour les champignons, il a une influence importante sur les processus biologiques et géochimiques des sols, car il constitue une réserve de calcium pour l'écosystème.
Présence dans le corps humain et chez les mammifères
L'oxalate est originaire du foie, dans les cellules sanguines rouges ou érythrocytaires et en plus petite quantité dans le rein. Il est formé à partir du métabolisme des acides aminés (tels que la phénylalanine et le tryptophane) et par oxydation du dialdéhyde glioxal,.
La vitamine C peut également devenir oxalate lors de l'exécution de sa fonction antioxydante.
L'oxalate de calcium se trouve dans les pierres qui se forment dans les reins des personnes ou des animaux atteints d'une maladie rénale.
Les calculs ou pierres d'oxalate de calcium so-appelés sont formés par la cristallisation ou l'agrégation du CAC2SOIT4 Dans l'urine globale avec du calcium et de l'oxalate. Cela signifie que l'urine contient à la fois du calcium et de l'oxalate qu'il n'est pas possible que ledit composé reste dissous, mais précipite ou passe à l'état solide sous forme de cristaux.
Chez l'homme
La formation de sable ou de pierres dans les reins est une maladie appelée néphrolithiase; Il attaque environ 10% de la population et environ 75% de ces pierres sont composées de CAC à oxalate de calcium2SOIT4.
 L'oxalate de calcium peut former des pierres dans les reins. Auteur: vsrao. Source: Pixabay.
L'oxalate de calcium peut former des pierres dans les reins. Auteur: vsrao. Source: Pixabay. La formation et la croissance des cristaux d'oxalate de calcium dans le rein se produisent parce que chez certaines personnes l'urine est sursaturée avec ledit sel. L'oxalate de calcium se développe dans l'urine acide dans le pH inférieur à 6,0.
Peut vous servir: IsóbarosLa suparée se produit lorsque l'excrétion ou l'élimination de ce sel (qui est très peu soluble dans l'eau) à travers l'urine se produit dans un petit volume d'eau.
Facteurs qui affectent l'apparence des calculs rénaux
Parmi les facteurs qui favorisent la formation de sable d'oxalate de calcium figurent un excès de calcium dans l'urine ou l'hypercalciurie, l'excès d'oxalate dans l'urine ou l'hyperoxalurie, des éléments dérivés de l'alimentation et de l'absence d'inhibiteurs.
Un excès d'oxalate peut se produire lorsque des quantités élevées d'épinards, rugueuses, soja, noix et chocolat sont ingérées, entre autres aliments.
 Le chocolat peut être une source d'oxalate de calcium et favoriser l'apparence des pierres dans les reins. Auteur: Alexander Stein. Source: Pixabay.
Le chocolat peut être une source d'oxalate de calcium et favoriser l'apparence des pierres dans les reins. Auteur: Alexander Stein. Source: Pixabay. Cependant, il existe des substances qui inhibent ou empêchent la formation de pierres. Parmi les composés qui évitent les calculs figurent de petites molécules telles que le citrate et le pyrophosphate, et de grandes molécules telles que les glycoprotéines et les protéoglycanes.
Façons d'éviter la formation de pierres d'oxalate de calcium
Une bonne stratégie pour prévenir la récidive du sable ou les calculs d'oxalate de calcium, notamment l'augmentation de l'ingestion de liquide, l'augmentation des aliments riches en calcium (tels que les produits laitiers) et restreindre le sel de table (NaCl), les protéines animales, les protéines animales et les repas riches en oxalate.
Dans les animaux
Depuis le début de l'année 2000. Il semble que cela dépend du type de nourriture que ces animaux ingèrent et ont à voir avec l'acidité de la carence en urine et en magnésium (MG).
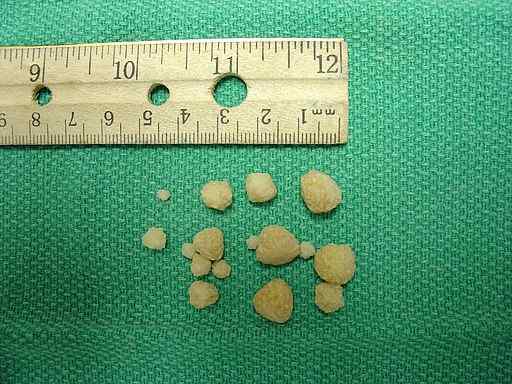 Les pierres d'oxalate de calcium trouvées dans la vessie urinaire d'un chien. Joel Mills / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /). Source: Wikimedia Commons.
Les pierres d'oxalate de calcium trouvées dans la vessie urinaire d'un chien. Joel Mills / CC BY-SA (http: // CreativeCommons.Org / licences / by-sa / 3.0 /). Source: Wikimedia Commons. Réponse corporelle à l'excès d'oxalate
Il est prouvé que les humains et les animaux réagissent à l'excès d'oxalate en augmentant le nombre de bactéries qui peuvent dégrader l'oxalate.
Certaines de ces bactéries sont Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis et Bacillus sp., entre autres, et sont présents naturellement dans l'intestin.
Applications
Selon les sources consultées, l'oxalate de calcium est utilisé dans le revêtement en céramique.
Il a été utilisé pour couvrir les sculptures et autres éléments artistiques du calcaire, et il a été constaté qu'il améliore la dureté du matériau, diminue sa porosité et augmente sa résistance aux acides et aux alcalis.
 En Italie, il a été vécu pour couvrir les objets calcaire des musées avec de l'oxalate de calcium pour les préserver. Auteur: Source: Moni Quayle. Pixabay.
En Italie, il a été vécu pour couvrir les objets calcaire des musées avec de l'oxalate de calcium pour les préserver. Auteur: Source: Moni Quayle. Pixabay. Problèmes dans certains processus
Dans l'industrie de la pulpe et du papier, l'oxalate de calcium peut former des incrustations qui causent de nombreux problèmes dans le processus.
Pour éviter sa formation dans les conduits de processus industriels ou les tuyaux.
Il peut vous servir: chlorure de cobalt (Cocl2 (: structure, nomenclature, propriétésIl a également tendance à s'accumuler sous forme de pierre dans les conteneurs où la bière est fabriquée, où elle doit être éliminée pour éviter la formation de micro-organismes qui peuvent donner un goût désagréable à la consommation d'alcool.
Des risques
À des concentrations élevées, l'oxalate peut provoquer la mort chez les animaux et parfois chez l'homme en raison principalement de ses effets corrosifs.
L'accumulation d'oxalate et de son acide conjugué, de l'acide oxalique, peut provoquer des troubles tels que le dysfonctionnement cardiaque, les pierres d'oxalate de calcium, l'insuffisance rénale et même la mort par toxicité.
Les références
- Glasauer, s.M. et al. (2013). Métaux et métalloïdes, transformation par micro-organismes. Oxalates. En modulation de référence dans les systèmes terrestres et les sciences de l'environnemento. Récupéré de ScienceDirect.com.
- Baumann, J. M. et Casella, R. (2019). Prévention de la néphrolithiase calcique: l'influence de la diurèse sur la cristallisation de l'oxalate de calcium dans l'urine. ADV Precium, 2019; 2019: 3234867. NCBI a récupéré.NLM.NIH.Gouvernement.
- Breshears, m.POUR. et conférer, à.W. (2017). Le système urinaire. Calcul de calcium. En base pathologique de la maladie vétérinaire (sixième édition). Récupéré de ScienceDirect.com.
- Huang, et. er al. (2019). TGE Handilation de l'oxalate dans le corps TGE et l'origine TGE de l'oxalate dans les stons d'oxalate de calcium. Urol Int, 2019 5 décembre: 1-10. NCBI a récupéré.NLM.NIH.Gouvernement.
- Nilvebrant, n.-SOIT. et al. (2002). Biotechnologie dans l'industrie des pâtes et papier. En cours en biotechnologie. Récupéré de ScienceDirect.com.
- Pahira, J.J. Et pevzner, m. (2007). Néphrolithiase. Pierres de calcium. Dans Penn Clinical Manual of Urology. Récupéré de ScienceDirect.com.
- Worcester, e. M. (1994). Inhibiteurs de croissance des cristaux d'oxalate de calcium urinaire. J Am Soc Nephrol 1994 nov; 5 (5 Suppl 1): S46-53). Récupéré de Jasn.Asnjournals.org.
- Finkielstein, V.POUR. et Goldfarb, D.S. (2006). Stratégies pour prévenir les pierres d'oxalate de calcium. NCBI a récupéré.NLM.NIH.Gouvernement.
- OU.S. Bibliothèque nationale de médecine. (2019). Oxalate de calcium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Peck, un.B. et al. (2015). Micro-organismes dégraissant des oxalate ou enzymes dégraissant l'oxalate: Wich est la thérapie future pour la dissolution enzymatique des urolithes oxalate de calcium dans la maladie récurrente de la pierre? Urolithiase, 2016 février; 44 (1): 27-32. NCBI a récupéré.NLM.NIH.Gouvernement.
- Holames, R.P. et al. (2016). Abaisser l'excrétion d'oxalate urinaire pour décriller la pierre d'oxalate de calcium dirapar. Urolithiase. 2016 février; 44 (1); 27-32. NCBI a récupéré.NLM.NIH.Gouvernement.
- Cyzar, t.M. (1998). Oxalate de calcium: traitement de surface du calcaire. Journal of Conservation and Museum Studies 4, pp.6-10. Récupéré de JCMS-Journal.com.
- Wikimedia (2019). Oxalate de calcium. Récupéré de.Wikipédia.org.
- « Caractéristiques de recherche qualitative, types, techniques, exemples
- Fonctionnalisme (psychologie) Origine, caractéristiques et représentants des auteurs »

