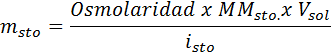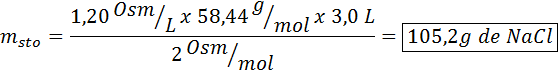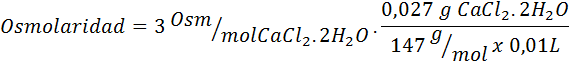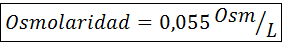Osmolarité
- 3231
- 656
- Raphaël Meyer
Qu'est-ce que l'osmolarité?
La Osmolarité Il s'agit d'une unité de concentration qui indique la concentration molaire de l'ensemble de particules osmotiquement actives présentes dans une solution. En d'autres termes, l'osmolarité est la molarité des particules osmotiquement actives.
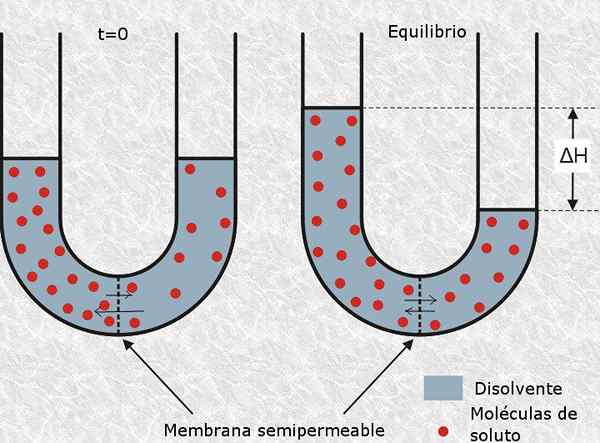
est défini comme particule osmotiquement active à cette molécule neutre ou ionique qui ne peut pas traverser une membrane semi-perméable, comme la membrane cellulaire. La présence de ce type de particules génère une pression osmotique dans la solution, et donc son nom.
Le nombre de moles de particules osmotiquement actives est appelée Osmoles (représenté par le symbole OSM), donc l'osmolarité est exprimée en unités de OSM / L.
L'importance de l'osmolarité
L'osmolarité est un concept d'une grande importance pour la biologie et la médecine, car l'équilibre osmotique des cellules avec leur environnement est essentiel pour leur survie. Par exemple, l'injection d'une solution avec une osmolarité très élevée ou très faible par voie intraveineuse peut facilement causer la mort à un patient.
 L'osmolarité est un aspect essentiel des solutions en médecine et en biologie
L'osmolarité est un aspect essentiel des solutions en médecine et en biologie D'un autre côté, une technique très courante que les biologistes cellulaires utilisent pour briser les cellules de différents types est par la lyse osmotique. Il s'agit de placer les cellules dans une solution hypotonique (avec une très faible osmolarité) de sorte que l'eau de la solution les pénètre par osmose et les éclate.
Cela le rend très important, à la fois pour les médecins et pour les biologistes et les professionnels d'autres domaines, connaissant, mesurer ou savoir comment calculer l'osmolarité d'une solution.
Peut vous servir: concentration en pourcentageDifférences entre l'osmolarité et l'osmolalité
Lorsque vous parlez d'osmolarité, il est également nécessaire de parler d'osmolalité. L'osmolalité est similaire à l'osmolarité, de la même manière que la moralité est similaire à la molarité.
Tandis que l'osmolarité indique le Nombre d'osmoles par litre de solution (OSM / L), L'osmolalité indique la même chose, mais Pour chaque kilogramme de solvant (OSM / kg).
L'osmolalité a l'avantage qui ne dépend pas du volume de la solution, ni de la densité ou de la température. Pour cette raison, une solution aura la même osmolalité à 25 ° C qu'à 37 ° C. En revanche, son osmolarité de 37 ° C sera légèrement inférieure à son osmolarité à 25 ° C, en raison de l'augmentation du volume de dilatation thermique.
L'osmolarité est généralement plus facile à mesurer expérimentalement que l'osmolarité. Cependant, l'osmolarité est plus facile à calculer et est une unité plus facile à travailler lorsque les dilutions sont préparées.
Comment l'osmolarité d'une solution est-elle calculée?
Il existe plusieurs façons de calculer l'osmolarité d'une solution, selon les informations comptées. Il peut être calculé à partir de:
- Les quantités de soluté et de solution.
- La molarité des solutés présents.
- Concentrations d'ions individuels.
- Le pourcentage m / v des solutés, entre autres.
Dans tous les cas, le calcul est basé sur la formule générale de l'osmolarité, qui est:

Où nOSM C'est le nombre d'osmoles présents dans la solution et Vsoleil C'est le volume du même exprimé en litres. Le nombre d'osmoles est calculé en multipliant le nombre de moles dans le soluté par le nombre de particules dans lesquelles il se dissocie en solution.
Peut vous servir: mélanges hétérogènes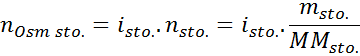
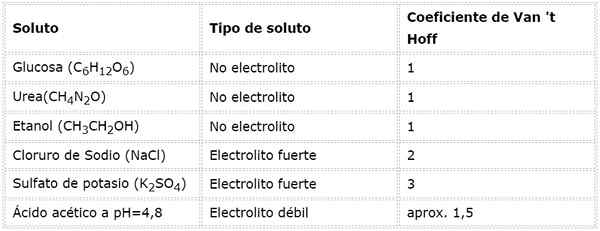
Dans cette équation, nfaire un sto C'est le nombre de moles de soluté, mfaire un sto est sa masse (en g), MMfaire un sto C'est sa masse molaire (en g / mol) et Toifaire un sto C'est le coefficient de van 't hoff du soluté. Ce coefficient a une valeur de 1 pour les solutés non électrolytes (Comme le glucose, par exemple).
Pour les électrolytes forts qui sont complètement dissociés (comme le chlorure de sodium, NaCl), le coefficient de fourgonnette est égal au nombre total d'ions dans lesquels chaque mole du composé se dissocie.
Par exemple, dans le cas du sulfate de potassium, k2Swin4, dont la réaction de dissociation est:
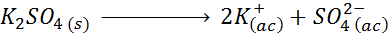
Chaque mol du sel qui se dissout produit 3 moles d'ions (2 k ions+ Et 1 So ion42-), Pour ce que I = n = 3.
Dans le cas d'électrolytes faibles, le calcul est plus compliqué, mais ils sont généralement déterminés expérimentalement. Le tableau suivant résume les coefficients de Van 'T hoff pour certains solutés communs.
Exemples de calcul d'osmolarité
1. Exemple 1
Déterminez l'osmolarité d'une solution préparée en dissolvant 10 g de NaCl et 10 g de glucose dans 100 ml de solution
Solution: Dans ce cas, les osmoles de chaque soluté sont calculés séparément puis ajouter. Les masses molaires sont respectivement de 58,45 g / mol et 180 g / mol, et les coefficients ve 't hoff sont 2 et 1:
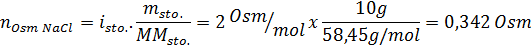
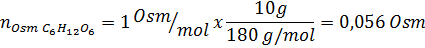
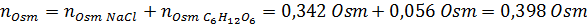
Maintenant, nous calculons l'osmolarité en utilisant la formule, sachant que 100 ml est égal à 0,100L:
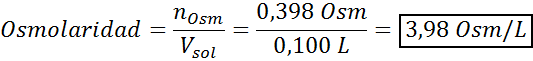
Enfin, l'osmolarité de la solution est de 3,98 OSM / L.
2. Exemple 2
Déterminer l'osmolarité d'une solution de sulfate de potassium de 0,05.
Solution: Si nous connaissons déjà la molarité du soluté, le calcul de l'osmolarité est aussi simple que de multiplier cette concentration par le facteur de fourgonnette.
Peut vous servir: benzaldéhyde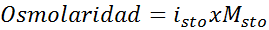
Dans ce cas, le facteur de sel est 3.
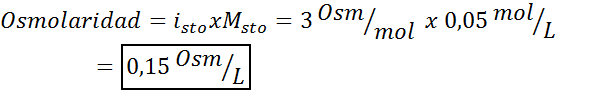
3. Exemple 3
Déterminer l'osmolarité d'un échantillon de plasma contenant 0,125 M ions sodium, 0,020 m d'ions potassium et 0,145 ions chlorure.
Solution: L'osmolarité des ions individuels est égale à leur molarité, car les ions ne se dissocient pas davantage et ont un I = 1. Pour cette raison, dans ce cas, il est seulement nécessaire de se multiplier par I = 1 Chaque concentration et ajouter:
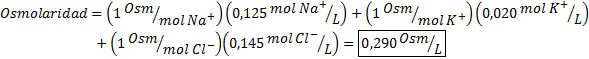
4. Exemple 4
Calculez l'osmolarité d'une solution contenant 27 mg de plafond2.2h2Ou pour 10 ml de solution
Solution: Le poids moléculaire cochl2.2h2Ou c'est 147 g / mol. Lors de la dissolution, ce sel est séparé en 2 molécules d'eau et trois ions. Cependant, les molécules d'eau ne sont pas des particules osmotiquement actives afin qu'elles ne soient pas prises en compte pour le calcul de l'osmolarité, et le coefficient de ce composé est 3.

5. Exemple 5
Quelle masse de chlorure de sodium est nécessaire pour préparer 3 litres d'une solution dont l'osmolarité est 1,20 OSM / L?
Solution: Dans ce cas, comme la masse de soluté est demandée et que nous avons le volume et la concentration, il suffit de nettoyer la masse de la formule d'osmolarité.