Orbitales dégénérées

- 3630
- 452
- Raphaël Meyer
 Schéma d'énergie avec les orbitales occupées par des électrons manquants. Source: Gabriel Bolívar
Schéma d'énergie avec les orbitales occupées par des électrons manquants. Source: Gabriel Bolívar Les Orbitales dégénérées Ce sont ceux trouvés au même niveau d'énergie. Selon cette définition, ils doivent avoir le même numéro quantique principal n. Ainsi, les orbitales 2s et 2p sont dégénérées, car elles appartiennent au niveau d'énergie 2, bien qu'il soit connu que leurs fonctions des ondes angulaires et radiales sont différentes.
Comme les valeurs de n, Les électrons commencent à occuper d'autres sous-niveaux d'énergie, tels que D et F Orbitals.
Chacune de ces orbitales a ses propres caractéristiques qui, à première vue, sont observées dans leurs formes angulaires; Ce sont les figures sphériques, des haltères (p), des feuilles de trèfle (d) et globulaires (f).
Parmi eux, il y a une différence d'énergie, appartenant même au même niveau n.
Par exemple, un schéma d'énergie avec les orbitales occupées par des électrons manquants (un cas anormal) est illustré à l'image supérieure (un cas anormal).
On peut voir que de tous, le plus stable (le moins d'énergie) est l'orbital NS (1s, 2s, ...), tandis que le NF est le plus instable (celui avec la plus grande énergie).
Orbitales dégénérées d'un atome isolé
Orbitales dégénérées, avec la même valeur que n, Ils sont dans la même ligne dans un schéma d'énergie.
Pour cette raison, les trois bandes rouges qui symbolisent les orbitales p sont situées dans la même ligne; Comme de la même manière, faites les rayures violettes et jaunes.
Le schéma d'image viole la règle du puits: les orbitales d'une plus grande énergie sont remplies d'électrons.
Peut vous servir: acides et bases: différences, caractéristiques, exemplesLorsque les électrons s'accouplent, l'orbitale perd de l'énergie et exerce une plus grande répulsion électrostatique sur les électrons manquants des autres orbitales.
Cependant, de tels effets ne sont pas pris en compte dans de nombreux diagrammes d'énergie. Si c'est le cas, et obéissant à la règle du puits sans remplir complètement les orbitales D, il serait vu qu'ils cessent d'être dégénérés.
Comme indiqué ci-dessus, chaque orbitale a ses propres caractéristiques. Un atome isolé, avec sa configuration électronique, veut dire ses électrons dans le nombre précis d'orbitales qui leur permettent de les héberger.
Seuls ceux en énergie peuvent être considérés comme dégénérés.
Orbitales p
Les trois rayures rouges pour les orbitales de l'image de l'image indiquent que les deux pX, pet Et Pz Ils ont la même énergie.
Il y a un électron disparu dans chacun, décrit par quatre nombres quantiques (n, l, ml et SP), tandis que les trois premiers décrivent les orbitales.
La seule différence entre eux est indiquée par le moment magnétique ml, qui tire la trajectoire de pX Sur un axe x, pet sur l'axe y, et pz sur l'axe z.
Les trois sont les mêmes, mais ils ne diffèrent que par leurs orientations spatiales. Pour cette raison, ils sont toujours dessinés dans l'énergie, c'est-à-dire dégénéré.
Comme le même, un atome d'azote inomotif (avec configuration 122s22 P3) Vous devez garder vos trois orbitales dégénérées. Cependant, le scénario d'énergie change brusquement s'il est considéré comme un atome de N dans une molécule ou un composé chimique.
Il en est ainsi parce que bien que pX, pet Et Pz Ils sont les mêmes en énergie, cela peut varier dans chacun d'eux s'ils ont des environnements chimiques différents; c'est-à-dire s'ils sont liés à différents atomes.
Peut vous servir: isopréno: structure, propriétés, applicationsOrbitales D
Les cinq rayures violettes indiquent les orbitales D. Dans un atome isolé, même s'ils ont des électrons jumelés, ils sont considérés que ces cinq orbitales sont dégénérées. Cependant, contrairement aux orbitales P, cette fois il y a une différence marquée dans leurs formes angulaires.
Par conséquent, leurs électrons voyagent dans l'espace qui varient d'une orbite D à un autre.
Cela cause, selon le Théorie cristalline des champs, qu'une perturbation minimale provoque un Énergie qui se déroule des orbitales; C'est-à-dire que les cinq bandes violettes se séparent, laissant un écart énergétique entre eux:
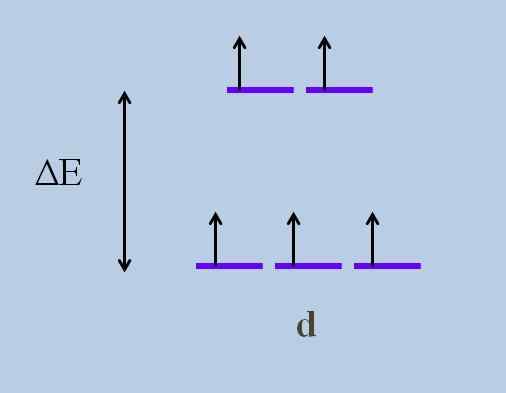 Schéma de déploiement d'énergie des orbitales. Source: Gabriel Bolívar
Schéma de déploiement d'énergie des orbitales. Source: Gabriel Bolívar Quelles sont les orbitales ci-dessus et celles ci-dessous? Ceux ci-dessus sont symbolisés comme etg, Et ceux ci-dessous t2 g.
Notez à quel point toutes les rayures violettes étaient initiales, et maintenant un ensemble de deux orbitales a été formé etg plus d'énergie que l'autre ensemble de trois orbitales t2 g.
Cette théorie permet d'expliquer les transitions D-D, auxquelles de nombreuses couleurs observées dans les composés des métaux de transition (Cr, Mn, Faith, etc.).
Cette perturbation électronique est due aux interactions de coordination du centre métallique avec d'autres molécules appelées Ligands.
Orbitales f
Et avec les orbitales F, les sept rayures jaunes, la situation est encore compliquée. Ses adresses spatiales varient considérablement entre elles, et la visualisation de leurs liens devient trop complexe.
En fait, il est considéré que les orbitales f sont d'une couche interne qu'ils ne «participent pas sensiblement» à la formation de liens.
Il peut vous servir: oxyde perchlorique (CL2O7)Lorsque l'atome isolé avec des orbitales F est entouré d'autres atomes, les interactions commencent et se déroulent (perte de dégénérescence):
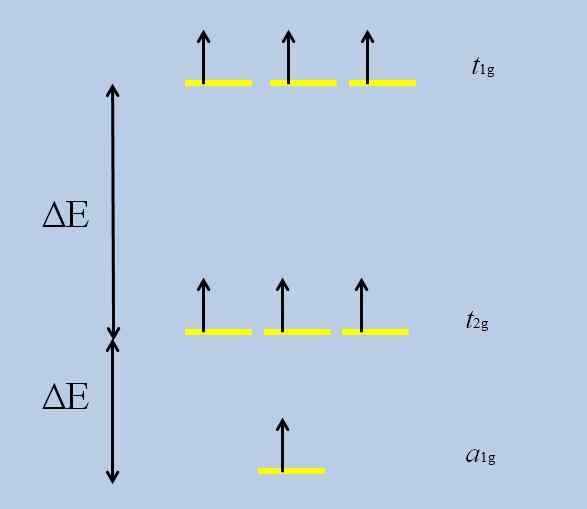 Schéma de perte de dégénérescence. Source: Gabriel Bolívar
Schéma de perte de dégénérescence. Source: Gabriel Bolívar Notez que maintenant les rayures jaunes forment trois ensembles: t1g, t2 g et pour1g, Et ils ne sont plus dégénérés.
Orbitales hybrides dégénérées
Il a été constaté que les orbitales peuvent se dérouler et perdre une dégénérescence. Cependant, bien que cela explique les transitions électroniques, cela ne clarifie pas comment et pourquoi il existe différentes géométries moléculaires. Ici, les orbitales hybrides entrent.
Sa principale caractéristique est qu'ils sont dégénérés. Ainsi, ils découlent du mélange de caractères orbitaux S, P, D et F, pour provoquer des hybrides dégénérés.
Par exemple, trois orbitales P sont mélangées avec une S pour donner quatre orbitales SP3. Toutes les orbitales SP3 Ils sont dégénérés et ont donc la même énergie.
Si en outre, deux orbitales sont mélangées avec les quatre sp3, Six orbitales seront obtenues3d2.
Et comment les géométries moléculaires expliquent-elles? Comme il y en a six, avec des énergies égales, elles doivent par conséquent être guidées symétriquement dans l'espace pour générer des environnements chimiques égaux (par exemple, dans un composé MF6).
Quand ils le font, un octaèdre de coordination se forme, ce qui est égal à une géométrie octaédrique autour d'un centre (m).
Cependant, les géométries présentent généralement des distorsions, ce qui signifie que même les orbitales hybrides ne sont pas complètement dégénérées.
Par conséquent, en conclusion, les orbitales dégénérées n'existent que dans des atomes isolés ou des environnements hautement symétriques.
Les références
- Définition du dégéré. Récupéré de: Chemicool.com
- Atomes et orbitales atomiques. Récupéré de SparkNotes.com
- Whitten, Davis, Peck & Stanley. Chimie. (8.ª ed.). Cengage Learning.

