Nombres quantiques pour ce que sont l'utilisation et ce que sont
- 877
- 253
- Prof Noah Collet
Les nUmeters quantum Ils sont utilisés pour décrire l'état quantique des électrons dans l'atome et provenir de la solution de l'équation de Schrödinger pour le plus simple de tous: l'hydrogène.
L'équation de Schrödinger est une équation différentielle, dont les solutions sont Fonctions d'onde et ils sont désignés par la lettre grecque ψ. Des solutions infinies peuvent être soulevées et son carré équivaut à la probabilité de trouver l'électron dans une petite région d'espace, appelée orbital.
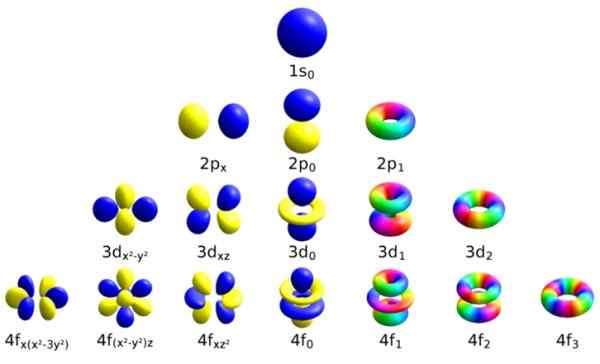
 Chacune de ces orbitales atomiques se distingue par un certain ensemble de nombres quantiques. Source: Wikimedia Commons.
Chacune de ces orbitales atomiques se distingue par un certain ensemble de nombres quantiques. Source: Wikimedia Commons. Chaque orbitale a défini les caractéristiques qui la distinguent des autres, comme l'énergie, le moment angulaire et le spin, une propriété entièrement quantique de l'électron et qui est responsable, entre autres, des effets magnétiques.
La façon d'identifier chaque orbitale est de le distinguer à travers un ensemble de nombres qui le décrivent, et ce sont précisément les nombres quantiques:
-N: est le principal numéro quantique.
-ℓ: le numéro quantique azimutal.
-mℓ, C'est le numéro magnétique.
-ms, Le numéro de spin.
[TOC]
Que sont les nombres quantiques pour?
Les nombres quantiques servent à décrire l'état des électrons à l'intérieur de l'atome. Ce modèle atomique dans lequel l'électron tourne autour du noyau est inexact, car il n'est pas cohérent avec la stabilité atomique ou avec un grand nombre de phénomènes physiques observés.
C'est pourquoi Danish Niels Bohr (1885-1962) fait en 1913 une proposition audacieuse: l'électron ne peut être trouvé que dans certaines orbites stables, dont la taille dépend d'un numéro entier appelé n.
Plus tard, en 1925, le physique autrichien Erwin Schrödinger (1887-1961) a levé une équation différentielle dans les dérivés partiels, dont les solutions décrivent l'atome d'hydrogène. Sont les fonctions d'onde ψ mentionnées au début.
Cette équation différentielle comprend les trois coordonnées spatiales plus le temps, mais lorsqu'elle n'est pas incluse, la solution de l'équation de Schrödinger est analogue à celle d'une onde stationnaire (une onde qui se propage entre certaines limites).
Fonctions d'onde
L'équation temporelle indépendante de Schrödinger est résolue dans les coordonnées sphériques et la solution est écrite comme le produit de trois fonctions, une pour chaque variable spatiale. Dans ce système de coordonnées, au lieu d'utiliser les coordonnées des axes cartésiens X, et et z Les coordonnées sont utilisées r, θ et φ. De cette manière:
Peut vous servir: circuit parallèleψ (r, θ, φ) = r (r) ⋅f (θ) ⋅g (φ)
La fonction d'onde est intangible, malgré la mécanique quantique, il nous dit que l'amplitude carrée:
| ψ (r, θ, φ) |2
C'est-à-dire que le module ou la valeur absolue de la fonction d'onde, au carré, est un nombre réel qui représente la probabilité de trouver l'électron, dans une certaine région autour du point dont les coordonnées sont r, θ et φ.
Et ce fait est quelque chose de plus concret et tangible.
Pour trouver la fonction d'onde, vous devez résoudre trois équations différentielles ordinaires, une pour chaque variable r, θ et φ.
Les solutions de chaque équation, qui seront les fonctions r (r), f (θ) et g (φ), contiendront les trois premiers nombres quantiques mentionnés.
Quels sont les nombres quantiques?
Ci-dessous, nous décrivons brièvement la nature de chaque numéro quantique. Les trois premiers, comme indiqué ci-dessus, découlent des solutions de l'équation de Schrödinger.
Le quatrième numéro a été ajouté par Paul Dirac (1902 - 1984) en 1928.
Numéro quantique principal
Il est indiqué par n et indique la taille de l'orbitale autorisée, ainsi que l'énergie de l'électron. Plus sa valeur est élevée, plus l'électron du noyau est et son énergie sera également, mais en retour, elle réduit sa stabilité.
Ce nombre provient de la fonction R (R), qui est la probabilité de trouver l'électron à une certaine distance r du noyau, qui est déterminé par:

-Planck constante: h = 6 626 × 10 -3. 4 J.s
-Masse électronique met = 9.1 × 10-31 kg
-Charge d'électrons: E = 1.6 × 10-19 C.
-Constante électrostatique: k = 9 × 10 9 N.m2/ C2
Lorsque n = 1 correspond au rayon Bohr qui vaut environ 5.3 × 10−11 m.
Sauf pour la première couche, les autres sont subdivisés en sous-casquettes ou sous-niveaux. Chaque couche a une énergie dans l'électron volt donné par:
Peut vous servir: ondes mécaniques: caractéristiques, propriétés, formules, types
- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- Ou (n = 5)
- P (n = 6)
- Q (n = 7).
En théorie, il n'y a pas de limite supérieure pour n, mais en pratique, il est observé qu'il n'atteint que n = 8. La moins que l'énergie possible correspond à n = 1 et est celle du État fondamental.
Numéro quantique azimutal ou moment angulaire
Indiqué par la lettre italique, ce nombre détermine la forme des orbitales, lors de la quantification de l'ampleur du moment angulaire orbital de l'électron.
Vous pouvez prendre des valeurs entières et positives entre 0 et N-1, par exemple:
-Quand n = 1, alors ℓ = 0 et il y a un seul sous-niveau.
-Si n = 2, alors ℓ peut valoir 0 ou 1, vous avez donc deux sous-niveaux.
-Et si n = 3, alors ℓ suppose les valeurs 0, 1 et 2 et il y a 3 sous-niveaux.
Il peut être suivi indéfiniment, bien que comme indiqué précédemment, dans la pratique n atteint jusqu'à 8. Les sous-niveaux sont désignés par des lettres: s, p, d, F et g Et ils augmentent de l'énergie.
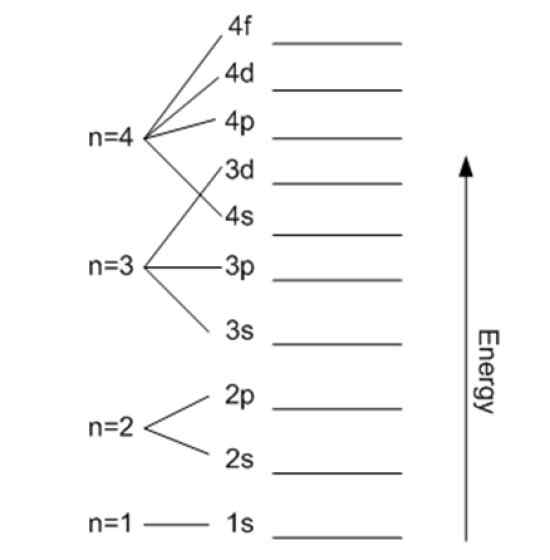 L'énergie est liée au numéro quantique principal. Source: Wikimedia Commons.
L'énergie est liée au numéro quantique principal. Source: Wikimedia Commons. Nombre quantique magnétique mℓ
Ce nombre décide de l'orientation de l'orbitale dans l'espace et sa valeur dépend du ℓ.
Pour un ℓ donné, il y a (2ℓ + 1) des valeurs entières de m ℓ, correspondant aux orbitales respectives. Ceux-ci sont:
-ℓ, (- ℓ + 1),… 0,… (+ ℓ -1), + ℓ.
Exemple
Si n = 2, nous savons que ℓ = 0 et ℓ = 1, alors m ℓ Prenez les valeurs suivantes:
-Pour ℓ = 0: m ℓ = 0.
-Pour ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
L'orbital n = 2 a deux sous-niveaux, le premier avec n = 2, ℓ = 0 et m ℓ = 0. Ensuite, nous avons le deuxième sous-niveau: n = 2, ℓ = 1, avec 3 orbitales:
- N = 2, ℓ = 1, m ℓ = -1
- N = 2, ℓ = 1, m ℓ = 0
- N = 2, ℓ = 1, m ℓ = +1
Les trois orbitales ont la même énergie mais une orientation spatiale différente.
Nombre quantique de spin ms
Lors de la résolution de l'équation de Schrödinger en trois dimensions, les nombres déjà décrits surviennent. Cependant, dans l'hydrogène, une structure encore plus.
Il peut vous servir: Gase constante: ce que c'est, le calcul et les exemplesPar conséquent, en 1921, un autre physique, Wolfgang Pauli, a proposé l'existence d'un quatrième numéro: le numéro de spin M Ms, qui prend des valeurs de + ½ ou -½.
Avec ce numéro, une propriété très importante de l'électron est décrite, qui est le rotation, mot qui vient de l'anglais rotation (retournez-vous). Et le spin à son tour est lié aux propriétés magnétiques de l'atome.
Une façon de comprendre le spin est d'imaginer que l'électron se comporte comme un minuscule dipôle magnétique (un aimant avec des poteaux nord et sud), grâce à une rotation autour de son propre axe. Le virage peut être dans le même sens que les aiguilles d'horloge, ou dans la direction opposée.
Bien que Pauli ait suggéré l'existence de ce nombre, les résultats d'une expérience réalisée par Otto Stern et Walter Gerlach en 1922 l'avaient déjà prévu.
Ces scientifiques ont réussi à diviser un faisceau d'atomes d'argent par l'application d'un champ magnétique non uniforme.
La valeur de ms Cela ne dépend pas de n, ℓ et m ℓ. Graphiquement, il est représenté par une flèche: une flèche vers le haut indique le calendrier et une.
principe d'exclusion de Pauli
Le comportement des électrons dans l'atome est résumé dans le principe d'exclusion de Pauli, qui indique que deux électrons d'un atome ne peuvent exister dans le même état quantique.
Par conséquent, chaque électron doit avoir un ensemble différent de nombres quantiques n, ℓ, m ℓ et Ms.
L'importance des nombres quantiques et ce principe réside dans la compréhension des propriétés des éléments dans le tableau périodique: les électrons sont organisés en couches selon N, puis en sous-capitaines selon ℓ et le reste des nombres.
Les références
- Alonso, m. 1971. Fondations quantiques et statistiques. Fonds éducatif inter-américain.
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Chang, R. 2013. Chimie. 11va. Édition. Mc Graw Hill Education.
- Eisberg-Resnick. 1989. Physique quantique. Limusa - Wiley.
- Giambattista, un. 2010. La physique. 2e. Élégant. McGraw Hill.
- Rex, un. 2011. Fondamentaux de la physique. Pearson.
- Tippens, P. 2011. Physique: concepts et applications. 7e édition. McGraw Hill.
- « Contenu écrit d'accusation, comment le faire, modèle
- Types d'environnements sédimentaires et leurs caractéristiques, exemples »

