Numéro de coordination Qu'est-ce que, Calcul, exemples

- 4868
- 684
- Lucas Schneider
Il Numéro de coordination C'est la quantité d'atomes, d'ions ou de molécules qui interagissent avec un centre dans les composés ion et coordination. Ce concept peut également être appliqué aux molécules, en tenant compte du nombre d'atomes liés les uns aux autres au lieu du nombre de leurs liens.
Ce nombre est important car il définit les géométries des complexes, les densités de leurs phases matérielles, et même le caractère stéréochimique (spatial) de leurs réactivités. Pour simplifier leur définition, ils sont considérés comme un voisin du tout atome qui entoure un centre spécifique.
 Dans un domaine de pièces, nous pouvons apprécier ce que l'on entend par numéro de coordination
Dans un domaine de pièces, nous pouvons apprécier ce que l'on entend par numéro de coordination Considérez, par exemple, le sol composé de pièces d'image supérieures. Toutes les pièces ont la même taille, et si chacune est observée, elle est entourée de six autres; c'est-à-dire qu'ils ont six voisins, et donc le numéro de coordination (c.N.) Pour les pièces, c'est 6. Cette même idée s'étend maintenant à trois espaces de dimension.
Si leurs radios sont inégaux, tous n'auront pas le même numéro de coordination. Par exemple: plus la monnaie est grande, plus les voisins pourront interagir avec un plus grand nombre de pièces autour de lui. L'inverse se produit avec de petites pièces.
[TOC]
Concept de numéro de coordination
VS ION RADIOS. Numéro de coordination
Le numéro de coordination est le nombre de voisins les plus proches et qui, en principe, interagissent directement avec un centre, qui est principalement un ion métallique. Nous avons donc mis de côté les pièces pour considérer les sphères à la place.
Cet ion métallique mn+, où n Il est égal à son nombre d'oxydation ou de valence, interagit avec d'autres voisins (ionique ou moléculaire) appelés ligands. Plus il est haut n (+2, +3, etc.), le plus petit sera mn+ Et, par conséquent, les ligands seront obligés de s'approcher davantage pour interagir avec mn+.
Peut vous servir: graisse butyrique: Obtention, types, composition, utilisations, avantagesL'image suivante illustre ce qui précède:
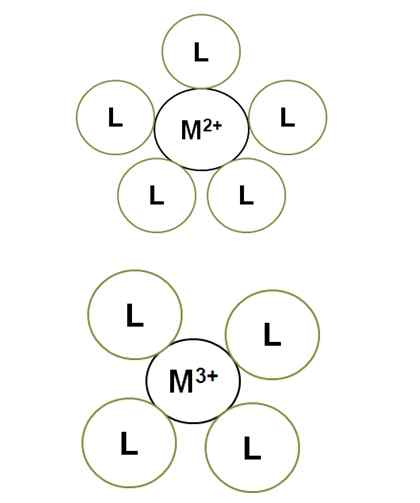 Variation du numéro de coordination avec la charge d'ions centraux. Source: Gabriel Bolívar.
Variation du numéro de coordination avec la charge d'ions centraux. Source: Gabriel Bolívar. M2+ Dans le complexe éclairé, il a un nombre de coordination de 5: il est entouré de 5 ligands L. En attendant, m3+ a un numéro de coordination 4. C'est parce que m3+, Pour avoir une plus grande ampleur de charge, ses contrats de rayon et, par conséquent, les liants doivent s'approcher davantage, ce qui augmente leurs répulsions électroniques.
C'est pourquoi les ions centraux encombrants, comme ceux appartenant à des métaux bloqués F, ou à la deuxième ou troisième période du bloc d, Ils ont tendance à avoir des nombres de coordination plus élevés (C.N. > 6).
Densités
Supposons maintenant que le complexe M3+ subit une pression. Un point arrivera où la pression sera telle qu'un autre lien est probable coordonné ou interagir avec m3+. C'est-à-dire que son nombre de coordination passera de 4 à 5.
En général, les pressions augmentent les nombres de coordination, alors que les voisins se forment mutuellement sur l'ion central ou l'atome. Par conséquent, les phases matérielles de ces substances deviennent plus denses, plus compactes.
Géométries
Les illustrations plus élevées ne disent rien sur les géométries autour de m2+ ou m3+. Cependant, nous savons qu'un carré a quatre sommets ou coins, tout comme un tétraèdre.
Ce raisonnement est conclu que la géométrie autour de m3+, dont C.N. Il est 4, il doit être tétraédrique ou carré. Mais lequel des deux? Pendant ce temps, les géométries pour m2+, dont C.N. Il est 5, ils peuvent être une pyramide carrée ou un bipiramidal trigonal.
Chaque C.N. Il a associé plusieurs géométries possibles, qui positionnent les liants à une distance favorable, de sorte qu'il y a la moindre répulsion entre eux.
Peut vous servir: liens interatomiquesComment le numéro de coordination est-il calculé ou déterminé?
Le numéro de coordination peut être calculé, parfois, directement à partir de la formule composée en question. Supposons le complexe anionique [Ni (CN)5]]3-. Quel est le numéro de coordination pour l'ion nickel, ou2+? Il suffit d'observer le coefficient stoechiométrique 5, ce qui indique qu'il y a 5 cn anions- coordonné ou interagissant avec le centre de Ni2+.
Cependant, ce n'est pas toujours facile. Par exemple, le composé CUCN semble avoir un nombre de coordination de 1 pour Cu2+ Quant au CN-. Cependant, il se compose de chaînes polymères réellement CU-CN-CU-CN, donc le numéro de coordination correct est 2.
C'est pourquoi le numéro de coordination est préférable pour le déterminer au lieu de le calculer. Comme? Déterminer les structures ioniques ou moléculaires des composés. Cela est possible grâce à des techniques instrumentales telles que la diffraction des rames X, les neutrons ou les électrons.
Exemples de numéros de coordination
Suivant et enfin quelques exemples de composés seront mentionnés pour chacun des numéros de coordination les plus courants. De même, il sera dit quelles sont leurs géométries respectives.
C.N. 2
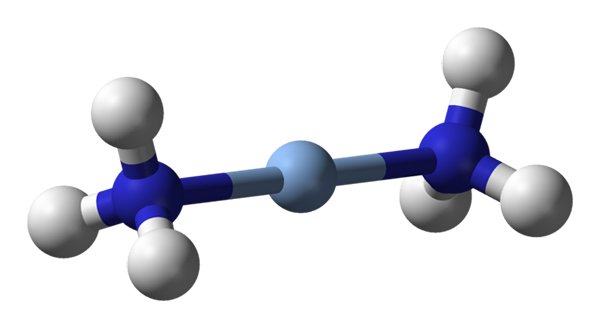 Ici, la géométrie linéaire de [Ag (NH3) 2] est observée+. Source: Benjah-Bmm27 / Domaine public
Ici, la géométrie linéaire de [Ag (NH3) 2] est observée+. Source: Benjah-Bmm27 / Domaine public A C.N. égal à 2 signifie que l'atome central ou l'ion n'a que deux voisins. Par conséquent, nous parlons de composés obligatoires des géométries linéaires. Entre eux nous avons:
-Hg (ch3)2
-[AG (NH3)2]]+
-PH3Faire une pause
C.N. 3
 Chaque atome de carbone de cette feuille de graphite est connecté à trois autres, il a donc trois voisins. Source: Benjah-Bmm27 / Domaine public
Chaque atome de carbone de cette feuille de graphite est connecté à trois autres, il a donc trois voisins. Source: Benjah-Bmm27 / Domaine public A C.N. égal à 3 signifie que l'atome central ou l'ion est entouré de trois voisins. Nous avons ensuite des géométries telles que: plan trigonal (triangulaire), pyramide trigonal et t. Des exemples de composés avec ce numéro de coordination sont:
Il peut vous servir: masse atomique: définition, types, comment le calculer, exemples-[Cu (CN)3]]2-
-[PT (PCY3)3], Où PCY fait référence au ligand tricylohexylophospine
-Graphite
C.N. 4
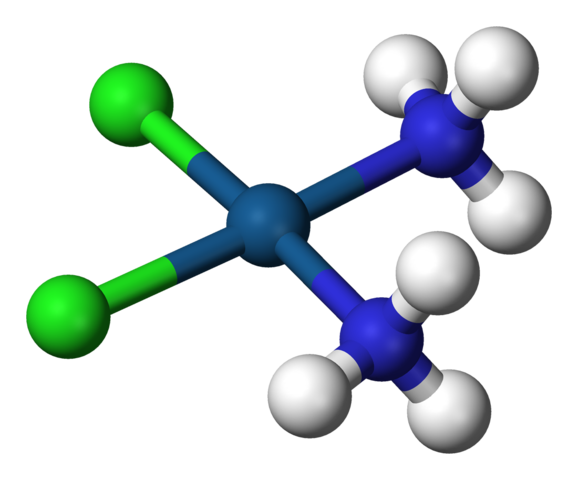 Géométrie carrée du cisplatine, CIS-PTCL2 (NH3) 2. Source: Benjah-Bmm27 / Domaine public
Géométrie carrée du cisplatine, CIS-PTCL2 (NH3) 2. Source: Benjah-Bmm27 / Domaine public A C.N. égal à 4 signifie que l'atome central ou l'ion est entouré de quatre voisins. Ses géométries possibles sont tétraédriques ou carrées. Des exemples de composés avec ce numéro de coordination ont les éléments suivants:
-Ch4
-Cocl2pyr2
-Cis-ptcl2(NH3)2
-[Alcl4]]-
-[Meuglement4]]2-
-Sncl4
-[Cro4]]2-
-[MNO4]]2-
Tous ces exemples, à l'exception du CIS-PTCL2(NH3)2, Ce sont des géométries tétraédriques.
C.N. 5
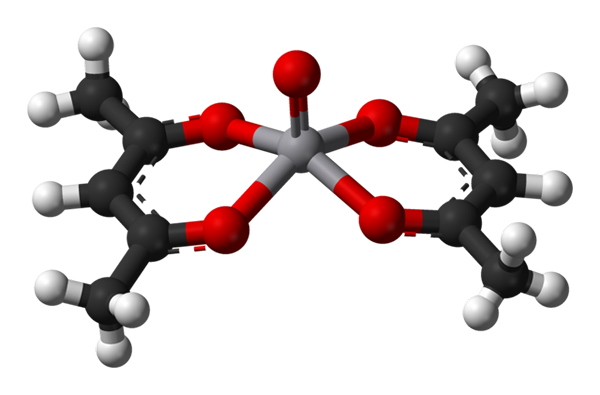 Géométrie pyramide carrée pour VO (ACAC) 2. Source: Benjah-Bmm27 / Domaine public.
Géométrie pyramide carrée pour VO (ACAC) 2. Source: Benjah-Bmm27 / Domaine public. A C.N. égal à 5 signifie que l'atome ou l'ion central est coordonné ou interagi avec cinq voisins. Ses géométries, déjà mentionnées, sont la pyramide carrée ou le bipiramidal trigonal. Comme exemples, nous avons ce qui suit:
-[Cobrn (ch2Ch2NME2)3]]
-[Fe (CO)5]]
-VO (ACAC)2, ACAC étant le ligand acétylacétonate
C.N. 6
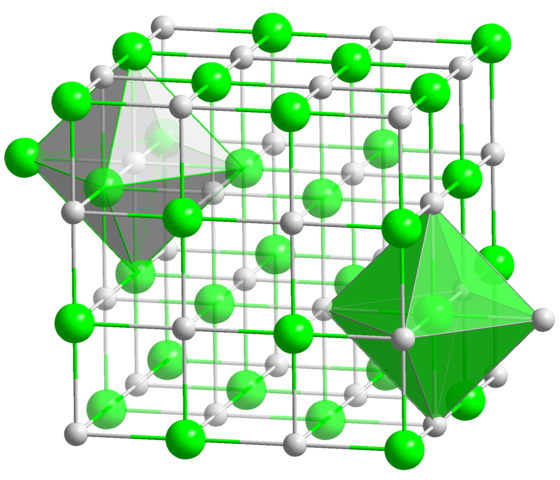 Dans la structure cristalline de la NaCl, chaque ion na + et Cl- ont six voisins, c'est donc le numéro de coordination pour les deux ions (voir les octaèdres). Source: Solide / domaine public
Dans la structure cristalline de la NaCl, chaque ion na + et Cl- ont six voisins, c'est donc le numéro de coordination pour les deux ions (voir les octaèdres). Source: Solide / domaine public Il s'agit de loin le nombre de coordination le plus courant parmi tous les composés. Rappelez-vous l'exemple des principales pièces. Mais au lieu de sa géométrie préférée est celle d'un hexagone plate, correspond à celle de l'octaèdre (normal ou déformé), en plus du prisme trigonal. Certains des nombreux exemples de composés avec ce numéro de coordination sont:
-[Alf6]]3-
-[CO (NH3)6]]3+
-[Zr (choisissez3)6]]2-
-NaCl (oui, sel de table)
-Mos2, Notez que c.N. Pour ce composé n'est pas 2
Autres
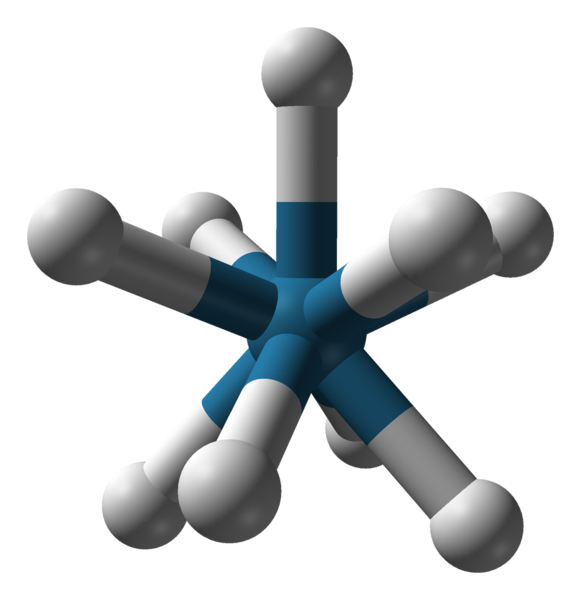 Géométrie triapadique triapadique triapadique de l'anion [Reh9] 2-. Source: Benjah-Bmm27 / Domaine public.
Géométrie triapadique triapadique triapadique de l'anion [Reh9] 2-. Source: Benjah-Bmm27 / Domaine public. Il y a d'autres numéros de coordination, de 7 à 15. Alors que c.N. être élevé, l'ion central ou l'atome doit être très grand, avoir peu de charge et en même temps que les ligands doivent être très petits. Quelques exemples de composés avec un tel C.N. Ils sont en dessous et pour terminer:
-K3[Nbof6], C.N. 7 et géométrie octaedro
-[MO (CN)8]]3-
-[Zr (OX)4]]2-, Étant du bœuf le ligand oxalate
-[Reh9]]2-
-[Dîne3)6]]2-, C.N. égal à 12
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Numéro de coordination. Récupéré de: dans.Wikipédia.org
- Les éditeurs d'Enyclopaedia Britannica. (s.F.). Numéro de coordination. Récupéré de: Britannica.com
- Prof. Robert J. Lancashire. (15 août 2020). Numéros de coordination et géométrie. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Helmestine, Anne Marie, Ph.D. (28 août 2020). Définition du numéro de coordination en chimie. Récupéré de: Thoughtco.com

