Structure du nitrobenzène (C6H5NO2), propriétés, utilisations, risques

- 2504
- 537
- Prof Noah Collet
Il nitrobenzène C'est un composé organique aromatique formé par un anneau benzénique C6H5- Et un groupe nitro -no2. Sa formule chimique est C6H5NON2. C'est un liquide huileux coloré ou jaune pâle, avec une odeur d'amandes amères ou des chaussures pour chaussures.
Le nitobenzène est un composé très utile dans l'industrie chimique car il permet d'obtenir une série de substances chimiques qui ont des utilisations variées. C'est parce qu'il peut être soumis à différents types de réactions.
 Nitrobencene, C6H5-NON2. Auteur: Marilú Stea.
Nitrobencene, C6H5-NON2. Auteur: Marilú Stea. Parmi les réactions chimiques importantes figurent la nitration (qui vous permet d'ajouter plus de groupes - pas2 à la molécule) et la réduction (l'opposé de l'oxydation comme les deux atomes d'oxygène du groupe nitro -NO sont éliminés2 et sont remplacés par des hydrogènes).
Avec Nitrobencene, vous pouvez préparer par exemple l'aniline et le para-acétaminophénol. Ce dernier est l'acétaminophène bien connu qui est un antipyrétique (médicament contre la fièvre) et un analgésique doux (médicament à la douleur mineure).
Le nitobenzène doit être manipulé avec prudence car il est irritant et toxique, il peut provoquer un type d'anémie, parmi plusieurs symptômes, et on pense qu'il peut provoquer un cancer. Il est également nocif pour l'environnement.
[TOC]
Structure
Le nitrobenzène C6H5-NON2 C'est une molécule plate formée par un anneau benzénique C6H5- auquel un groupe nitro est lié - pas2. Sa molécule est plate car il y a une interaction électronique entre le groupe nitro-pas2 Et l'anneau de benzène.
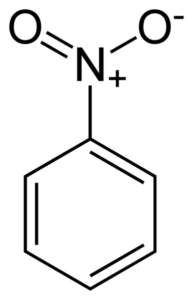 Structure plate de la molécule de nitrobenzène. Les électrons des liens anneaux à double liaison ont tendance à interagir avec le groupe Nitro -No2. Auteur: Benjah-bmm27. Source: Wikimedia Commons.
Structure plate de la molécule de nitrobenzène. Les électrons des liens anneaux à double liaison ont tendance à interagir avec le groupe Nitro -No2. Auteur: Benjah-bmm27. Source: Wikimedia Commons. Le groupe nitro -no2 tend à attirer les électrons de l'anneau benzénique C6H5-.
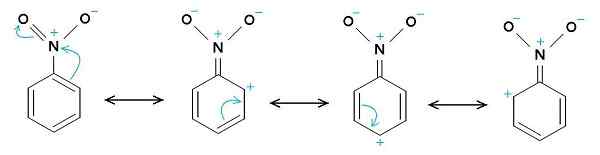 Structures de résonance du nitrobenzène. L'anneau de benzène a tendance à avoir une charge positive, tandis que le groupe Nitro -NO2 a tendance à avoir une charge négative. Le téléchargeur d'origine était Samuele Madini au Wikipedia italien. [Domaine public]. Source: Wikimedia Commons.
Structures de résonance du nitrobenzène. L'anneau de benzène a tendance à avoir une charge positive, tandis que le groupe Nitro -NO2 a tendance à avoir une charge négative. Le téléchargeur d'origine était Samuele Madini au Wikipedia italien. [Domaine public]. Source: Wikimedia Commons. C'est pourquoi la molécule a un côté légèrement plus négatif (où l'oxygène de -NO est2) et un côté légèrement plus positif (l'anneau de benzène).
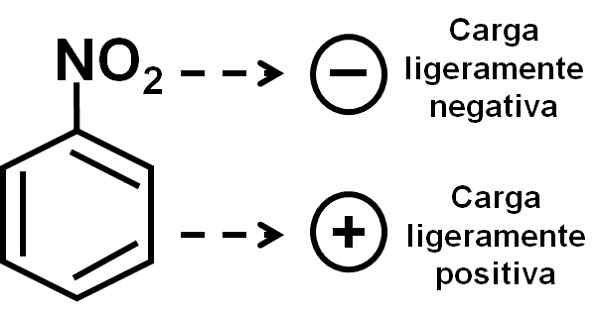 L'oxygène du groupe nitro a une charge légèrement négative par rapport à l'anneau benzénique. Auteur: Marilú Stea.
L'oxygène du groupe nitro a une charge légèrement négative par rapport à l'anneau benzénique. Auteur: Marilú Stea. Nomenclature
- Nitrobenzène.
- Nitrobenze.
- Nitrobenzole.
- Pétrole ou essence de Mirbano ou Mirbana (terme désaffecté).
Propriétés
État physique
Liquide huileux coloré à jaune pâle.
Poids moléculaire
123.11 g / mol.
Point de fusion
5,7 ºC.
Point d'ébullition
211 ºC.
Il peut vous servir: chlorure de cobalt (Cocl2 (: structure, nomenclature, propriétésPoint d'inflammation
88 ºC (méthode de tasse fermée).
Température d'auto-direction
480 ° C.
Densité
1 2037 g / cm3 à 20 ºC.
Solubilité
Petite eau soluble: 0,19 g / 100 g d'eau à 20 ° C. Complètement miscible avec l'alcool, le benzène et l'éther dietyl.
Propriétés chimiques
Le nitrobencène est stable jusqu'à environ 450 ° C de température dans laquelle il commence à se décomposer la formation (en l'absence d'oxygène) non, non2, benzène, biphényle, aniline, dibenzofurano et naphtalène.
Parmi les réactions importantes du nitrobencene figurent la réduction, la nitration, l'halogénation et la sulfonation.
La nitration de nitrobenzène produit initialement du méta-nitrobenzène et avec un long temps de réaction, le 1,3,5-nitobenzène est obtenu.
Réagir du brome ou du chlore avec du nitrobenzène en présence d'un catalyseur approprié est obtenu du 3-bromo-nitrobenzène (méta-bromonitrobencène) ou du 3-cllor-nitrobenzène (méta-chloronitrobenzène).
Un exemple de réduction est que lorsqu'il s'agit de l'étain (SN) dans l'acide chlorhydrique (HCL), les méta-halogénonitobenzènes sont obtenues par les méta-halogénoanylines.
La sulfonation du nitrobenzène est réalisée avec de l'acide sulfurique fumant à 70-80 ° C et le produit est méta-nitrobenzonique méta-nitrobenze. Cela peut être réduit avec du fer et du HCl pour donner de l'acide méthanyl.
Gradateur
Dans une solution de benzène C6H6 Les molécules de nitrobencene sont associées les unes aux autres. Dans ces paires, l'une des molécules est dans une position inversée par rapport à l'autre.
La formation de diamètres de nitrobenzène avec des molécules une dans une position inversée par rapport à l'autre est peut-être due au fait que chacun d'eux a un côté légèrement plus positif et un côté opposé avec une charge légèrement plus négative.
Dans le dimère, le côté avec une charge légèrement plus positive de l'une des molécules est peut-être situé à proximité de la charge légèrement négative de l'autre molécule, car les charges opposées sont attirées, et donc cela se produit avec les deux autres côtés.
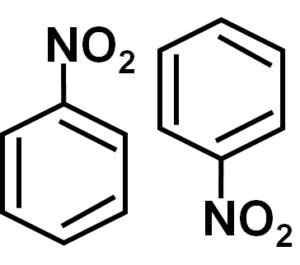 Numéro de Nitrobencene, c'est-à-dire deux molécules qui ont tendance à être ensemble dans certains solvants. Auteur: Marilú Stea.
Numéro de Nitrobencene, c'est-à-dire deux molécules qui ont tendance à être ensemble dans certains solvants. Auteur: Marilú Stea. Autres propriétés
Il présente une odeur similaire aux amandes ou pour polir des chaussures. En abaissant sa température solidifie sous la forme de cristaux jaune verdâtre.
Obtention
Vous obtenez le traitement du benzène C6H6 Avec un mélange d'acide nitrique HNO3 et l'acide sulfurique H2Swin4. Le processus est appelé nitration et implique la formation de l'ion nitronium2+ Grâce à la présence d'acide sulfurique h2Swin4.
- Nitronio ion no2+:
HNO3 + 2 h2Swin4 ⇔ H3SOIT+ + 2 HSO4- + NON2+ (Nitronio ion)
- Le nitronio ion attaque le benzène:
Peut vous servir: Erreur systématique: comment la calculer, en chimie, en physique, exemplesC6H6 + NON2+ → C6H6NON2+
- Nitrobencene est formé:
C6H6NON2+ + HSO4- → C6H5NON2 + H2Swin4
En résumé:
C6H6 + HNO3 → C6H5NON2 + H2SOIT
La réaction de nitration en benzène est très exothermique, c'est-à-dire que une chaleur est générée, donc c'est très dangereux.
Applications
Dans l'obtention de l'aniline et de l'acétaminophène
Nitrobencene est principalement utilisé pour synthétiser l'aniline C6H5NH2, qui est un composé largement utilisé pour la préparation des pesticides, des gencives, des colorants, des explosifs et des médicaments.
L'obtention de l'aniline se produit en réduisant le nitrobenzène dans un milieu acide en présence de fer ou d'étain, qui est effectué selon les étapes suivantes:
Nitrobenzène → Nitrosobenzène → phénylhydroxylamine → aniline
C6H5NON2 → C6H5Non → C6H5NHOH → C6H5NH2
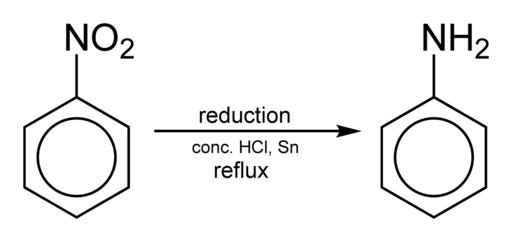 Réduction du nitrobencene pour obtenir de l'aniline. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Réduction du nitrobencene pour obtenir de l'aniline. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Selon les conditions, le processus peut être arrêté dans l'une des étapes intermédiaires par exemple dans la phénylhydroxylamine. À partir de la phénylhydroxylamine dans un environnement fortement acide, le para-aminophénol peut être préparé:
Phénylhdroxylamine → p-Aminophénol
C6H5NHOH → HOC6H4NH2
Ce dernier est traité avec de l'anhydride acétique pour obtenir un paracétamol (acétaminophène) un doux antipyrétique et un analgésique doux, c'est-à-dire un médicament pour traiter la fièvre et la douleur et la douleur et la douleur.
 Parfois, il est possible de se soigner avec l'acétaminophène aux enfants atteints de fièvre. L'acétaminophène est un dérivé du nitrobenzène. Auteur: Augusto Ordonnez. Source: Pixabay.
Parfois, il est possible de se soigner avec l'acétaminophène aux enfants atteints de fièvre. L'acétaminophène est un dérivé du nitrobenzène. Auteur: Augusto Ordonnez. Source: Pixabay.  Pilules d'acétaminophène, un dérivé du nitrobenzène. Paracetamol_acetaminophen_500_mg_pils.JPG: Tribe Michelle d'Ottawa, œuvre canadaderivative: anrie [cc by (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons.
Pilules d'acétaminophène, un dérivé du nitrobenzène. Paracetamol_acetaminophen_500_mg_pils.JPG: Tribe Michelle d'Ottawa, œuvre canadaderivative: anrie [cc by (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons. Une autre façon d'obtenir de l'aniline est de réduire le nitrobenzène avec du monoxyde de carbone (CO) dans un milieu aqueux en présence de très petites particules (nanoparticules) du paladium (PD) comme catalyseur.
C6H5-NON2 + 3 CO + H2O → C6H5-NH2 + 3 CO2
Dans l'obtention d'autres composés chimiques
Le nitobenzène est le point de départ pour obtenir une grande variété de composés utilisés tels que les colorants, les pesticides, les médicaments et les cosmétiques.
 Certains colorants sont obtenus grâce au nitrobenzène. Auteur: Edith Lüthi. Source: Pixabay.
Certains colorants sont obtenus grâce au nitrobenzène. Auteur: Edith Lüthi. Source: Pixabay. Par exemple, il permet d'obtenir le 1,3-Dinitrobencene qui, par chloration (ajout de chlore) et la réduction (élimination des atomes d'oxygène) génère du 3-chloroanylin. Ceci est utilisé comme intermédiaire pour les pesticides, les colorants et les médicaments.
Le nitobenzène a été utilisé pour préparer la benchidine qui est un colorant. De plus, le nitrobenzène sert à préparer la quinoline, l'azobenzène, l'acide méthanyl, le dyitobenzène, l'isocianate ou la pyroxiline parmi de nombreux autres composés.
Dans plusieurs applications
Le nitobenzène est utilisé ou utilisé comme:
Peut vous servir: hydrocarbures insaturés- Solvant d'extraction pour la purification des huiles de lubrification utilisées dans les machines
- Solvant pour les éthers de cellulose
- Mélangez ingrédient pour polir les métaux
- Dans les savons
- Dans des mélanges pour les chaussures polonaises
- Conservateur de peinture en aérosol
- Composant de mélange de polissage au sol
- Substitut d'essence aux amandes
- Dans l'industrie du parfum
- Dans la production de caoutchouc synthétique
- Solvant dans divers processus
 Nitobenzène fait partie de certains mélanges pour les chaussures polonaises. D-kuru [cc by-sa 3.0 AT (https: // CreativeCommons.Org / licences / by-sa / 3.0 / at / acte.dans)]. Source: Wikimedia Commons.
Nitobenzène fait partie de certains mélanges pour les chaussures polonaises. D-kuru [cc by-sa 3.0 AT (https: // CreativeCommons.Org / licences / by-sa / 3.0 / at / acte.dans)]. Source: Wikimedia Commons. Des risques
Le nitobenzène est toxique par inhalation, ingestion et absorption à travers la peau.
Irrite la peau, les yeux et les voies respiratoires. Il peut provoquer un type d'anémie appelé méthémoglobinemie qui consiste à réduire la capacité des globules rouges à libérer de l'oxygène dans les tissus et génère de la fatigue.
De plus, Nitrobencene provoque une dyspnée, des étourdissements, une vision bouleversée, un manque de souffle, un effondrement et une mort. Il endommage également le foie, la rate, les reins et le système nerveux central.
On estime qu'il peut s'agir d'un mutagène et peut-être provoquer un cancer humain, comme il l'a causé chez les animaux.
De plus, Nitrobencene ne doit pas être jeté dans l'environnement. Sa toxicité envers les animaux, les plantes et les micro-organismes le rend très nocif pour les écosystèmes.
La toxicité envers les micro-organismes diminue sa biodégradabilité.
Traitements pour son élimination de l'environnement
La pollution de l'environnement avec Nitrobencene peut se produire à travers le gaspillage des différentes industries qui l'utilisent, comme l'industrie des coloriages ou celle des explosifs.
Le nitobenzène est un très toxique et difficile à décomposer dans des conditions naturelles, pour cette raison, elle peut provoquer une contamination potable et des systèmes d'irrigation sévère.
En raison de sa stabilité élevée et de sa toxicité envers les micro-organismes, il est souvent sélectionné comme modèle dans les études de traitement des eaux usées.
Diverses façons sont étudiées pour éliminer le nitrobenzène à l'eau contaminée. L'un d'eux est par une dégradation photocatalytique, c'est-à-dire en utilisant la lumière du soleil comme accélérateur de la réaction de dégradation en présence de dioxyde de titane du titane2.
 Avec un réacteur au soleil, il est possible d'éliminer la pollution de l'eau avec le nitrobencene. Mihai-Cosmin Pascariu [CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Avec un réacteur au soleil, il est possible d'éliminer la pollution de l'eau avec le nitrobencene. Mihai-Cosmin Pascariu [CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Les méthodes de microélectrolyse ont également été testées avec succès avec un catalyseur de fer (foi) et du cuivre (CU) dans la céramique. La microélectrolyse permet au nitrobenzène de se décomposer à travers un courant électrique.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Nitrobenzène. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Morrison, R.T. Et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.
- Moldoveanu, s.C. (2019). Pyrolyse d'autres composés d'azote. En pyrolyse des molécules organiques (deuxième édition). Récupéré de ScienceDirect.com.
- Smith, P.W.g. et al. (1969). Composés nitration-nitro aromatiques. Substitutions électrophiles. En chimie aromatique. Récupéré de ScienceDirect.com.
- Windholz, M. et al. (éditeurs) (1983). L'indice Merck. Une enyclopédie des produits chimiques, des médicaments et des biologiques. Dixième édition. Merck & Co., Inc.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A22. VCH VERLAGSGELLSCHAFT MBH.
- Whang, t.-J. et al. (2012). Dégradation photocatalytique ironie des UV du nitrobenzène par titania liant le tube de quartz. Journal international de photoénergy, volume 2012, articles ID 681941. Hyndawi a récupéré.com.
- Shikata, t. et al. (2014). Nitrobenzène Anti-Paralal Dimer Formation dans des solvants non polaires. AIP Advances 4, 067130 (2014). Récupéré de Doaj.org.
- Krogul-Obczak, un. et al. (2019). Réduction du nitrobenzène à l'aniline par CO / H2Ou dans le témoin des nanoparticules de palladium. Catalysets 2019, 9, 404. MDPI a récupéré.com.
- Yang, B. et al. (2019). Production à l'échelle pilote, propriétés et application de Fe / Cu Catalytic-Ceramic-Filler pour les composés de nitrobenzène Traitement des eaux usées. Catalysets 2019, 9, 11. MDPI a récupéré.com.
- « Formule d'avantage mécanique, équations, calculs et exemples
- 110 Expressions d'amour éternelles pour les petits amis et les maris »

