Structure, propriétés et utilisations du nitrite de potassium (KNO2)

- 2590
- 63
- Justine Charpentier
Il Nitrite de potassium C'est un sel inorganique dont la formule chimique est comme2, qui est chimiquement et pharmacologiquement lié au nitrate de potassium3. Son apparence physique se compose de cristaux blancs jaunâtres, hautement hygroscopiques, et donc des délits; c'est-à-dire qu'ils se dissolvent rapidement dans des environnements humides.
Sa formule indique que la proportion de k ions+ et non2- Il est 1: 1 et reste unis par des forces électrostatiques ou par des liens ioniques. Les sources naturelles pures n'ont pas apparemment trouvé pour leurs cristaux, bien que des anions niter se trouvent dans les sols, les engrais, les plantes et les animaux.
 Cristaux de potassium nital. Source: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Cristaux de potassium nital. Source: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'image supérieure montre à quoi ressemblent les cristaux de Kno2, Avec des tons jaunes prononcés. Si ces cristaux sont laissés en contact avec l'air, ils absorberont l'humidité pour devenir une solution aqueuse; Solution qui a généré des controverses pour savoir si son utilisation est bénéfique ou non.
D'un autre côté, ses cristaux, en très petites quantités (200 ppm), sont utilisés pour saliner les viandes et garantir leur conservation contre l'action bactérienne. Aussi, le Kno2 Améliore la couleur des viandes, les retournant plus rougeâtre; Cependant, il est soumis à plusieurs restrictions pour éviter les effets toxiques de ce sel sur le corps.
[TOC]
Structure de nitrite de potassium
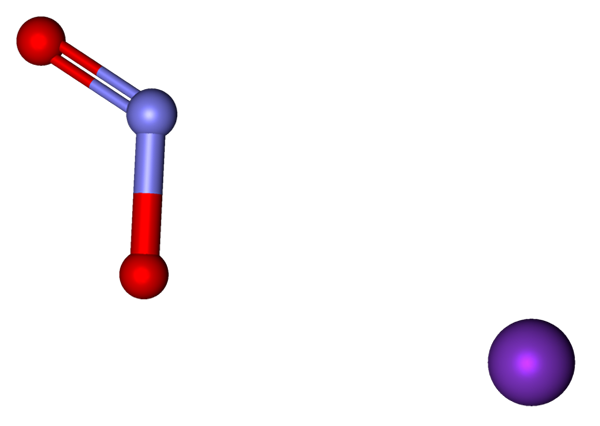 Des ions qui composent le KNO2 représenté avec un modèle de sphères et de barres. Source: Marinavladivok [CC0].
Des ions qui composent le KNO2 représenté avec un modèle de sphères et de barres. Source: Marinavladivok [CC0]. Les ions présents dans le nitrite de potassium sont indiqués ci-dessus. Le cation k+ correspond à la sphère violette, tandis que l'anion ne2- Il est représenté par les sphères bleuâtres et rouges.
L'anion non2- Il est montré avec une double liaison et une simple [o = n-o]-; Mais en réalité, les deux liens sont les mêmes que la résonance de la charge négative entre eux.
Les k ions+ et non2- Ils s'attirent dans l'espace pour organiser un motif structurel avec la moindre énergie; C'est, où les répulsions entre les charges égales sont minimes. Et donc les cristaux Kno croient2, dont la cellule unitaire est sensible aux changements de température, quelle transition de phase.
Peut vous servir: Stanislao CannizzaroPar exemple, à basse température (moins de 25 ° C) les cristaux kno2 adopter un système monoclinique (phase I). Lorsque la température dépasse 25 ° C, une transition de phase monoclinique rhomboébique se produit (phase II). Enfin, au-dessus de 40 ° C les cristaux kno2 changer pour être cubique (phase III).
Aussi, le Kno2 peut présenter d'autres phases cristallines (phases IV, V et VI) sous des pressions élevées. Avec ça, k ions+ et non2- Ils finissent par bouger et ont commandé de différentes manières dans leurs cristaux purs.
Propriétés
Masse moléculaire
85 1038 g / mol.
Densité
1 9150 g / ml.
Point de fusion
440,02 ° C (mais commence à se décomposer à 350 ° C, émettant des fumées toxiques).
Point d'ébullition
537 ° C (explosion).
Solubilité dans l'eau
312 g / 100 g d'eau à 25 ° C.
Délicturation
Sa solubilité dans l'eau est telle qu'elle est hygroscopique; Tellement, qui présente la délicoscence, absorbant suffisamment d'humidité pour se dissoudre. Cette affinité pour l'eau peut être due à la stabilité énergétique que les k ions gagnent+ Lorsqu'il est hydratant, ainsi qu'une enthalpie de réseau cristallin faible pour les cristaux Kno2.
Les cristaux peuvent absorber l'eau sans se dissoudre pour devenir hydrate2· H2SOIT. Dans Hydrate, la molécule d'eau accompagne les ions, ce qui modifie la structure cristalline.
Cet hydrate (ou plusieurs d'entre eux) peut être formé en dessous de -9 ° C; À une température plus élevée, l'eau se dissout et hydrate les ions, déformant le verre.
Solubilité dans d'autres solvants
Légèrement soluble dans les alcools chauds et très soluble en ammoniac.
pH
6-9. Ses solutions aqueuses sont donc alcalines, car l'anion ne2- Il peut hydrolyser.
Nomenclature
À Kno2 Il peut également être nommé d'autres manières. «Nitrite de potassium» correspond au nom de ce sel selon la nomenclature des stocks; «Potassium nitrito», selon la nomenclature systématique, dans laquelle la seule valence de potassium, +1 est mise en évidence; et dioxonitrate (iii) du potassium, selon la nomenclature systématique.
Il peut vous servir: Dibenzalacetona: propriétés, mécanisme de réaction, utilisations, risquesDioxonitrate de potassium (III), met en évidence la valence +3 de l'atome d'azote. Même le nom le plus recommandé par l'IUPAC pour le KNO2, `` Potassium Nitrite '' continue d'être le plus confortable et le plus facile à retenir.
Obtention
Le moyen le plus direct de le synthétiser, mais avec des performances plus faibles, est par la décomposition thermique de nitrate de potassium ou de salpêtre à 400 ° C ou plus:
2kno3 => Kno2 + SOIT2
Cependant, une partie du Kno2 finit par se décomposer par la chaleur, en plus d'autres produits.
Une autre méthode pour le préparer ou le synthétiser avec des performances plus élevées consiste à réduire le KNO3 En présence de plomb, de cuivre ou de zinc. L'équation de cette réaction est la suivante:
Kno3 + Pb => kno2 + PBO
Le potassium et le nitrate de plomb sont mélangés stœchiométriquement dans une casserole en fer, où ils fusionnent avec une agitation et un chauffage constants pendant une demi-heure. L'oxyde de plomb (II) est jaune, et la pâte résultante est chaude et traitée avec de l'eau bouillante. Puis le mélange chaud filtre.
Le filtre chaud bouillonne avec du dioxyde de carbone pendant cinq minutes, ce qui précipitera le carbonate de plomb, PBCO3, insoluble. De cette façon, le plomb est terminé. L'acide nitrique dilué au filtrage est ajouté jusqu'à ce que le pH soit neutre, il est autorisé à refroidir, et enfin l'eau s'évapore de sorte que les cristaux de KNO se forment2.
Applications
Additif et réactif
Le nitrite de potassium est utilisé comme additif pour guérir les viandes rouges, en maintenant leur goût et plus de couleur pendant le stockage, tandis que les retombées de l'action bactérienne et certaines toxines, telles que les botulines. Par conséquent, il présente une action antibactérienne.
Le kno2 Il ne s'oxyde pas, qui réagit avec la myoglobine de la viande et, par conséquent, finit par modifier sa couleur rouge naturelle. Ensuite, lorsque la viande est cuite, elle acquiert sa couleur rose forte caractéristique.
Peut vous servir: 20 exemples de sublimation chimique et de caractéristiquesCependant, dans des conditions sans spécifier le KNO2 réagit avec les protéines de viande pour donner naissance à la nitrosamine, qui peut devenir cancérigène.
D'un autre côté, le Kno2 (Bien que de préférence nano2) Il s'agit d'un réactif analytique qui peut être utilisé dans la synthèse des colorants azoïques (la réaction de l'acide nitreux avec des amines aromatiques) et dans l'analyse des acides aminés.
Antidote
Bien qu'il ait ses effets négatifs, Kno2 Il agit comme un antidote chez les patients empoisonnés atteints de cyanures et de sulfure d'hydrogène. Son mécanisme est d'oxyder les centres de foi2+ à la foi3+ des groupes que nous avons des hémoglobines, produisant de la méthémoglobine, qui réagit ensuite avec les anions CN- et HS-.
Médecins
Dans le jus gastrique de l'estomac, l'anion ne2- Il est réduit à non, qui est connu pour avoir une action vasodilatatrice, augmentant le flux sanguin. Dans d'autres régions du corps où le pH ne suffit pas2-.
Kno a été utilisé2 pour traiter les affections et les maladies telles que l'angine de poitrine et l'épilepsie (avec des effets secondaires très négatifs).
Les références
- Wikipédia. (2019). Nitrite de potassium. Récupéré de: dans.Wikipédia.org
- Prébchem. (2016). Nitrite de potassium de préparation. Récupéré de: prepchem.com
- Mark Gilchrist, Angela C. Rivage, Nigel Benjamin. (2011). Nitrate et nitrite inorganiques et contrôle de la pression artérielle, recherche cardiovasculaire, volume 89, numéro 3, 15 février 2011, pages 492-498, doi.org / 10.1093 / CVR / CVQ309
- Se publier. (2019). Nitrite de potassium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Formulation chimique. (2018). Nitrite de potassium. Récupéré de: Formulation Quimica.com
- Centre national pour l'avancement des sciences de la translation. (2011). Nitrite de potassium. Récupéré de: médicaments.ncats.Io
- Richard J. Eley, Paul B. Addis et Joseph J. Mâchoire. (1992). Nitrite en viande. Université du Minnesota.
- N. R. Rao, B. Prakash et m. Natarajan. (1975). Transformations de la structure cristalline dans les nitrites, nitrates et carbonates inorganiques. Département de chimie, Institut indien de technologie, Kanpur, Inde.
- « Caractéristiques de la parole politique, types, problèmes et exemples
- Causes de pollution des ordures, conséquences et exemples »

