Méthodes de séparation des mélanges homogènes
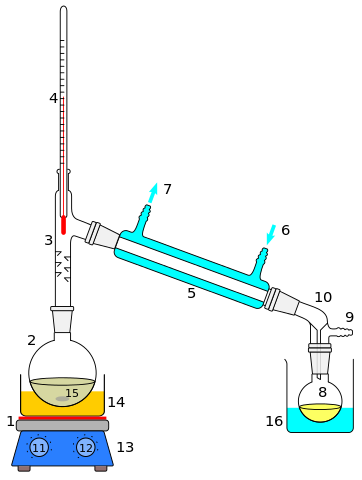
- 2069
- 179
- Adrien Remy
Les Méthodes de séparation des mélanges homogènes Ce sont tous ceux qui, sans utiliser de réactions chimiques, permettent d'obtenir les composants ou les solutés qui intègrent la même phase; c'est-à-dire d'un liquide, d'un solide ou d'un gaz.
Ces mélanges homogènes sont constitués de solutions, dans lesquelles les particules de soluté sont trop petites pour pouvoir les distinguer à l'œil nu. Ils sont si petits, qu'il n'y a pas de filtres étroits ou sélectifs pour les conserver pendant que la solution les transfère. Des techniques telles que la centrifugation ou la magnétisation ne vous aident pas à séparer.
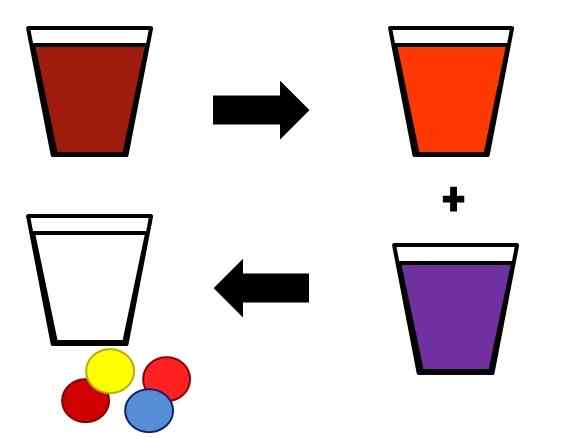 Exemple illustratif de la façon dont les mélanges homogènes peuvent se séparer par étapes. Source: Gabriel Bolívar.
Exemple illustratif de la façon dont les mélanges homogènes peuvent se séparer par étapes. Source: Gabriel Bolívar. Un exemple de la façon dont les solutions sont séparées dans leurs composants sont indiqués ci-dessus. Le mélange initial (brun) est séparé en deux composants, également homogènes (orange et violet). Enfin, à partir des deux mélanges résultants, le solvant (blanc) et les quatre paires respectives de solutés (jaune rouge et bleu rouge) sont obtenues.
Parmi les méthodes ou techniques de séparation des solutions, nous avons l'évaporation, la distillation, la chromatographie et la cristallisation fractionnée. Selon la complexité du mélange, plus d'une de ces méthodes doit être utilisée jusqu'à ce qu'elle casse l'homogénéité.
[TOC]
Les principales méthodes de séparation des mélanges
- Évaporation
 L'évaporation est la méthode la plus simple pour séparer les mélanges homogènes d'un seul soluté.
L'évaporation est la méthode la plus simple pour séparer les mélanges homogènes d'un seul soluté. Les mélanges homogènes les plus simples sont les solutions où un seul soluté a été dissous. Par exemple, dans l'image supérieure, il existe une solution colorée due à l'absorption et à la réflexion de la lumière visible avec les particules de son soluté.
S'il a bien remué pendant sa préparation, il n'y aura pas de régions plus claires ou sombres que les autres; Ils sont tous les mêmes, uniformes. Ces particules colorées ne peuvent pas être séparées du solvant par aucune méthode mécanique, vous aurez donc besoin d'énergie en chaleur (triangle rouge) pour l'atteindre.
Il peut vous servir: disulfure de carbone (CS2): structure, propriétés, utilisations, risquesAinsi, la solution colorée est chauffée à l'ouverture pour accélérer et permettre l'évaporation du solvant à l'extérieur de son récipient. Au fur et à mesure que cela se produit, le volume qui sépare les particules de soluté diminue et, par conséquent, ses interactions augmentent et se terminent lentement.
Le résultat final est que le soluté coloré reste au bas du récipient et que le solvant s'est complètement évaporé.
L'inconvénient de l'évaporation est que, plutôt que de séparer les solutés, son objectif est d'éliminer le solvant en le chauffant à son point d'ébullition. Le solide restant peut être composé de plusieurs solutés et est donc nécessaire à partir d'autres méthodes de séparation pour la définir dans ses composants isolés.
- Distillation
 Distillation
Distillation La distillation est peut-être la méthode de séparation des solutions ou des mélanges homogènes. Son utilisation s'étend aux sels ou métaux fondu. Le soluté est la plupart du temps un liquide, dont le point d'ébullition diffère en plusieurs degrés par rapport au solvant.
Lorsque la différence entre ces points d'ébullition est élevée (supérieure à 70 ºC), une simple distillation est utilisée; Et sinon, alors une distillation fractionnaire est effectuée. Les deux distillations ont plusieurs assemblages ou conceptions, ainsi qu'une méthodologie différente pour des mélanges de nature chimique différente (volatile, réactif, polaire, apolaire, etc.).
Dans la distillation, le solvant et les solutés sont conservés, et c'est l'une de ses principales différences concernant l'évaporation.
However, the rotaevaporation combines these two aspects: a liquid-solid or liquid-liquid mixture, such as that of a dissolved and miscible oil, they heat up until the solvent is removed, but it is collected in another container while the solid or the L'huile reste dans le récipient initial.
Peut vous servir: tableau périodique, à quoi sert-ilDistillation de l'air
L'air du condensat est soumis à une distillation fractionnée cryogénique pour séparer l'oxygène, l'azote, l'argon, le néon, etc. L'air, un mélange gazeux homogène, est transformé en liquide où l'azote, car c'est la composante majoritaire, agit en théorie comme un solvant; Et les autres gaz, également condensés, comme des solutés liquides.
- Chromatographie
La chromatographie, contrairement à d'autres techniques, ne peut pas fournir de rendements ou à distance similaires; c'est-à-dire qu'il n'est pas utile de traiter un mélange entier, mais une fraction insignifiante de la même. Cependant, les informations qu'elle fournissent est analytiquement précieuse, car elle identifie et classe les mélanges en fonction de sa composition.
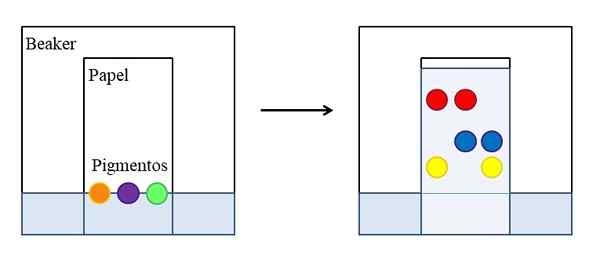 Papier ou chromatographie sur la couche fine. Source: Gabriel Bolívar.
Papier ou chromatographie sur la couche fine. Source: Gabriel Bolívar. Il existe différents types de chromatographies, mais la plus simple, qui est expliquée dans les écoles ou les cours pré-University, est celle de l'article, dont le principe est le même que celui développé sur une belle couche de matériau absorbant (généralement gel de silice ).
L'image supérieure montre que dans un bécher, plein d'eau ou un solvant spécifique, un papier est placé qui a été marqué une ligne de référence avec des gouttes ou des points de trois pigments sélectionnés (orange, violet et vert). Le bécher reste fermé de sorte que la pression est constante et sature des vapeurs de solvant.
Ensuite, le liquide commence à monter par le papier et à faire glisser les pigments. Les interactions pigmentaires ne sont pas les mêmes: certains sont plus forts et d'autres plus faibles. Plus le pigment ressent d'affinité pour le papier, moins il se lèvera dans le papier par rapport à la ligne qui a été initialement marquée.
Peut vous servir: vitesse constantePar exemple: le pigment rouge est celui qui ressent moins d'affinité pour le solvant, tandis que le jaune est à peine monté parce que le papier le conserve plus. On dit ensuite que le solvant est la phase mobile et le papier la phase stationnaire.
- Cristallisation fractionnaire
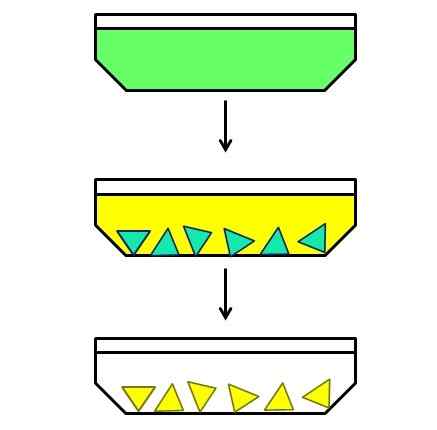 Exemple illustratif de cristallisation fractionnaire. Source: Gabriel Bolívar.
Exemple illustratif de cristallisation fractionnaire. Source: Gabriel Bolívar. Et enfin vous avez une cristallisation fractionnaire. Cette méthode pourrait peut-être cataloguer comme un hybride, car il commence à partir d'un mélange homogène pour mettre fin à un hétérogène. Par exemple, supposons qu'il existe une solution dans laquelle un solide vert a été dissous (image supérieure).
Les particules vertes sont trop petites pour se séparer manuellement ou mécaniquement. C'est aussi que le solide vert est un mélange de deux composants et pas un seul composé de cette couleur.
Ensuite, une solution de celui-ci est chauffée et laissée au repos pendant le refroidissement. Il s'avère que les deux composants, bien que très liés les uns aux autres, leur solvant de solvant est légèrement différent; Par conséquent, l'un des deux commencera à cristalliser d'abord puis l'autre.
Le composant bleu vert (au milieu de l'image) est le premier à cristalliser, tandis que le composant jaune est encore dissous. Étant des cristaux bleu vert, ils sont chauds avant que les cristaux jaunes n'apparaissent. Ensuite, alors que le solvant refroidit un peu plus, le jaune cristallise et une autre filtration est faite.
Thèmes d'intérêt
Méthodes de séparation du mélange.
Méthodes de séparation des mélanges hétérogènes.
Mélanges: composants et types.
Mélanges homogènes.
Mélanges hétérogènes.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Chelsea Schuyler. (2019). Chromatographie, distillion et filtrer: méthodes de séparation des mélanges. Étude. Récupéré de: étudier.com
- Fondation CK-12. (16 octobre 2019). Méthodes pour séparer les mélanges. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Bonne science. (2019). Séparation des mélanges. Récupéré de: Goodscience.com.Au
- Clark Jim. (2007). Chromatographie sur couche mince. Récupéré de: Chemguide.co.ROYAUME-UNI
- « Structure promise (PM), propriétés, obtention, utilisations
- Caractéristiques, fonctions et exemples de fonctions métalliques »

