Caractéristiques du modèle atomique Thomson, postulats, particules subatomiques
- 2311
- 517
- Noa Da silva
Il Modèle atomique Thomson Il a été créé par le physique anglais célébré j. J. Thomson, qui a découvert l'électron. En raison de cette découverte et de ses œuvres sur la conduction électrique dans les gaz, il a été décerné en 1906 au prix Nobel de physique.
De son travail avec les rayons de la cathode, il a été révélé que l'atome n'était pas une entité indivisible, comme Dalton l'avait postulé dans le modèle précédent, mais qu'il contenait une structure interne bien définie.

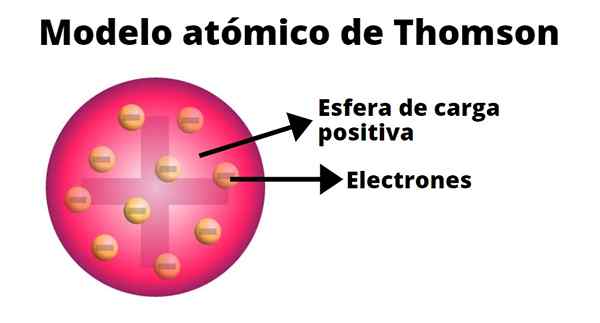
Thomson a développé un modèle d'atomes basé sur les résultats de ses expériences avec des rayons de cathode. En lui, il a affirmé que l'atome, électriquement neutre, était formé de charges positives et négatives de grande ampleur.
[TOC]
Quel était le nom du modèle atomique de Thomson et pourquoi?
Selon Thomson, la charge positive a été distribuée dans tout l'atome et les charges négatives y ont été intégrées comme s'ils étaient les raisins secs d'un pudding. De cette comparaison, le terme "pudding aux raisins secs a émergé, car le modèle était connu de manière informelle.
 Joseph John Thomson
Joseph John Thomson Alors que l'idée de Thomson est actuellement assez primitive, pour son temps, il a représenté une nouvelle contribution. Pendant la brève validité du modèle (de 1904 à 1910), il a eu le soutien de nombreux scientifiques, bien que beaucoup d'autres considéraient l'hérésie.
Enfin, en 1910, de nouvelles preuves ont émergé sur la structure atomique et le modèle de Thomson est resté rapidement de côté. Cela s'est produit dès que Rutherford a publié les résultats de ses expériences de dispersion, qui ont montré l'existence du noyau atomique.
Cependant, le modèle de Thomson a été le premier à postuler l'existence de particules subatomiques et leurs résultats ont été le fruit d'une expérimentation fine et rigoureuse. De cette façon, il a établi le précédent pour toutes les découvertes qui ont suivi.
Caractéristiques et postulats du modèle Thomson
Thomson est arrivé à son modèle atomique sur la base de plusieurs observations. La première était que les rayons X nouvellement découverts par Roentgen ont pu ioniser les molécules d'air. Jusque-là, le seul moyen d'ioniser était la séparation chimiquement des ions en solution.
Mais le physicien anglais a réussi à ioniser même les gaz monoatomiques tels que l'hélium, à travers les rayons X. Cela l'a amené à croire que la charge à l'intérieur de l'atome pouvait être séparée, et que donc ce n'était pas indivisible.Il a également observé que les rayons de cathode pouvaient être détournés par des champs électriques et magnétiques.
 J.J. Thomson, découvreur de l'électron. Source: Lafer.
J.J. Thomson, découvreur de l'électron. Source: Lafer. Ensuite, Thomson a conçu un modèle qui a correctement expliqué le fait que l'atome est électriquement neutre et que les rayons de cathode sont composés de particules avec une charge négative.
Surveillance des preuves expérimentales, Thomson a caractérisé l'atome comme suit:
-L'atome est une sphère solide électriquement neutre, avec un rayon approximatif de 10-dix m.
-La charge positive est distribuée plus ou moins uniformément par la sphère.
-L'atome contient des "corpuscules" chargés négativement, ce qui assure leur neutralité.
-Ces corpuscules sont les mêmes pour toutes les matières.
-Lorsque l'atome est en équilibre, il y a n Les corpuscules se sont régulièrement disposés en anneaux dans la sphère de charge positive.
-La masse de l'atome est uniformément distribuée.
Rayons de cathode
 Le faisceau d'électrons est dirigé de la cathode à l'anode.
Le faisceau d'électrons est dirigé de la cathode à l'anode. Thomson a réalisé ses expériences à l'aide de rayons de cathode, découverts en 1859. Les rayons de cathode sont des particules chargées négativement. Pour les produire, des tubes à cristal à vide sont utilisés, dans lesquels deux électrodes sont placées, appelées cathode et anode.
Peut vous servir: magnétisme: propriétés magnétiques des matériaux, utilisationsAlors un courant électrique est passé qui chauffe la cathode, qui émet ainsi un rayonnement invisible qui est dirigé directement à l'électrode opposée.
Pour détecter le rayonnement, qui n'est rien d'autre que les rayons de cathode, la paroi du tube est recouverte d'un matériau fluorescent. Lorsque le rayonnement arrive, la paroi du tube dégage une luminosité intense.
Si un objet solide est interposé sur le chemin des rayons de la cathode, il jette une ombre sur le mur du tube. Cela indique que les rayons se déplacent en ligne droite, et aussi qu'ils peuvent facilement les bloquer.
La nature des rayons de la cathode a été largement discutée, car sa nature était une inconnue. Certains pensaient qu'ils étaient des ondes électromagnétiques, tandis que d'autres ont fait valoir qu'ils étaient des particules.
Particules subatomiques de Modèle atomique Thomson
Le modèle atomique de Thomson est, comme nous l'avons dit, le premier à postuler l'existence de particules subatomiques. Les corpuscules de Thomson ne sont rien d'autre que les électrons, les particules fondamentales de l'atome chargé négativement.
Nous savons actuellement que les deux autres particules fondamentales sont le proton, chargé positivement et le neutron sans charge.
Mais ceux-ci n'ont pas été découverts au moment où Thomson a élaboré son modèle. La charge positive de l'atome y a été distribuée, n'a pas considéré aucune particule portant ladite charge et pour le moment il n'y avait aucune preuve de son existence.
Pour cette raison, son modèle a eu une existence éphémère, car au cours de quelques années, les expériences de dispersion de Rutherford ont ouvert la voie à la découverte du Proton. Et quant au neutron, Rutherford lui-même a proposé son existence quelques années avant qu'il ne soit finalement découvert.
Le tube Crookes
Sir William Crookes (1832-1919) a conçu le tube qui porte son nom vers 1870, avec l'intention d'étudier soigneusement la nature des rayons de cathode. Il a ajouté des champs électriques et des champs magnétiques et a observé que les rayons étaient détournés par ces.
 Schéma de tube à rayons cathodiques. Source: Knight, R.
Schéma de tube à rayons cathodiques. Source: Knight, R. De cette façon, Crookes et d'autres chercheurs, dont Thomson, ont constaté que:
- Un courant électrique a été généré à l'intérieur du tube à rayons cathodiques
- Les rayons étaient déviés par la présence de champs magnétiques, de la même manière que les particules chargées négativement étaient.
- Tout métal utilisé pour fabriquer la cathode était tout aussi bien pour produire des rayons de cathode, et leur comportement était indépendant du matériau.
Ces observations ont alimenté la discussion sur l'origine des rayons de la cathode. Ceux qui ont soutenu qu'ils étaient des vagues étaient basés sur le fait que les rayons de la cathode pouvaient voyager en ligne droite. De plus, cette hypothèse a très bien expliqué l'ombre qu'un objet solide interposé a jeté sur le mur du tube et dans certaines circonstances, il était connu que les vagues pouvaient provoquer une fluorescence.
Mais au lieu de cela, il n'était pas compris comment il était possible que les champs magnétiques détournaient les rayons de la cathode. Cela n'a eu que l'explication que si ces rayons étaient considérés comme des particules, une hypothèse que Thomson partageait.
Particules chargées dans des champs électriques et magnétiques uniformes
Une particule chargée avec une charge Q, éprouve une force de foi au milieu d'un champ électrique uniforme et, de magnitude:
Peut vous servir: Théorie ondulée de la lumière: explication, applications, exemplesFoi = qe
Lorsqu'une particule chargée traverse perpendiculairement un champ électrique uniforme, comme celui qui se produit entre deux plaques avec des charges opposées, elle subit une déviation, et donc une accélération:
QE = MA
a = qe / m
D'un autre côté, si la particule chargée se déplace avec une vitesse de magnitude V, au milieu d'un champ magnétique uniforme de magnitude B, la force magnétique FM qui éprouve a l'intensité suivante:
FM = QVB
Tant que la vitesse et les vecteurs de champ magnétique sont perpendiculaires. Lorsqu'une particule chargée affecte perpendiculairement dans un champ magnétique homogène, il subit également une déviation et son mouvement est circulaire uniforme.
Accélération centripète àc Dans ce cas, c'est:
QVB = MAc
À son tour, l'accélération centripète est liée à la vitesse de la particule V et au rayon R de la trajectoire circulaire:
pourc = V2/ R
Donc:
QVB = MV2/ R
Le rayon de la trajectoire circulaire pourrait être calculé comme suit:
R = mv / qb
Plus tard, ces équations seront utilisées pour recréer la façon dont Thomson a déduit le rapport de charge d'électrons.
L'expérience de Thomson
Thomson a passé un faisceau de rayons de cathode, un faisceau d'électrons, bien qu'il ne le savait toujours pas, à travers des champs électriques uniformes. Ces champs sont créés entre deux plaques conductrices chargées et séparées à une petite distance.
Les rayons de cathode ont également traversé un champ magnétique uniforme, observant l'effet que cela a eu sur le faisceau. À la fois dans un champ et dans l'autre, il y a eu une déviation dans les rayons, ce qui a conduit Thomson à penser à juste titre que le faisceau était composé de particules chargées.
Pour vérifier, Thomson a réalisé plusieurs stratégies avec les rayons cathodiques:
- Varier les champs électriques et magnétiques jusqu'à ce que les forces soient annulées. De cette façon, les rayons de cathode sont passés sans expérimenter la déviation. Correspondant aux forces électriques et magnétiques, Thomson a réussi à déterminer la vitesse des particules de poutre.
- Annulé l'intensité du champ électrique, de cette manière les particules ont suivi une trajectoire circulaire au milieu du champ magnétique.
- Combinée les résultats des étapes 1 et 2 pour déterminer le rapport de charge de la charge des "corpuscules".
Le rapport cargo électronique
Thomson a déterminé que le rapport cargo-performance des particules qui constituaient le faisceau des rayons de cathode ont la valeur suivante:
Q / m = 1.758820 x 10 11 C.kg-1.
Où q représente la charge du "corpuscule", qui est en fait l'électron et m C'est la masse de la même. Thomson a suivi la procédure décrite dans la section précédente, que nous recréons ici étape par étape, avec les équations qu'il a utilisées.
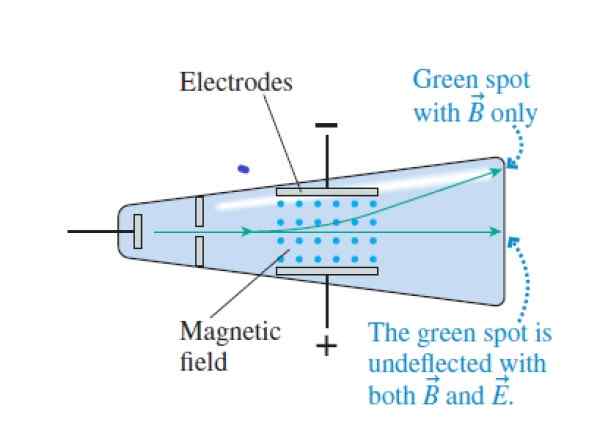 Lorsque les rayons de la cathode traversent la croix et les champs magnétiques croisés, ils passent sans déviation. Lorsque le champ électrique est annulé, ils affectent le haut du tube (le champ magnétique est indiqué avec les points bleus entre les électrodes). Source: Knight, R.
Lorsque les rayons de la cathode traversent la croix et les champs magnétiques croisés, ils passent sans déviation. Lorsque le champ électrique est annulé, ils affectent le haut du tube (le champ magnétique est indiqué avec les points bleus entre les électrodes). Source: Knight, R. Étape 1
Faites correspondre la force électrique et la force magnétique, passant le faisceau à travers les champs électriques et magnétiques perpendiculaires:
QVB = QE
Étape 2
Déterminez la vitesse acquise par les particules de faisceau lorsqu'elles passent directement sans déviation:
V = e / b
Étape 3
Annuler le champ électrique, ne laissant que le champ magnétique (maintenant il y a une déviation):
R = mv / qb
Avec V = E / B Résultats:
R = me / qb2
Le rayon de l'orbite peut donc être mesuré:
Q / M = V / RB
Ou bien:
Q / M = E / RB2
Prochaines étapes
La prochaine chose que Thomson a faite a été de mesurer le quotient Q / M à l'aide de cathodes en différents matériaux. Comme indiqué ci-dessus, tous les métaux ont émis des rayons de cathode avec des caractéristiques identiques.
Peut vous servir: réactance inductiveEnsuite, Thomson a comparé ses valeurs avec celles du rapport Q / M de l'ion hydrogène, obtenues par électrolyse et dont la valeur est d'environ 1 x 108 C / kg. Le quotient de charge de charge d'électrons est environ 1750 fois supérieur à l'ion hydrogène.
Par conséquent, les rayons de la cathode avaient une charge beaucoup plus grande, ou peut-être une masse beaucoup plus petite que l'ion hydrogène. L'ion hydrogène est simplement un proton, dont l'existence était connue du temps après les expériences de dispersion de Rutherford.
Aujourd'hui, il est connu que le proton est presque 1800 fois plus massif que l'électron et avec une charge de magnitude égale et de signe contraire à celui de l'électron.
Un autre détail important est qu'avec les expériences de Thomson, la charge électrique de l'électron n'a pas été déterminée, ni la valeur de sa masse séparément. Ces valeurs ont été déterminées par le biais des expériences de Millikan, qui ont commencé en 1906.
Thomson et Dalton modèles différences
La différence fondamentale de ces deux modèles est que Dalton pensait que l'atome est une sphère. Contrairement à Thomson, il n'a pas proposé l'existence de charges positives ou négatives. Pour Dalton, un atome était comme ceci:
 Dalton Atom
Dalton Atom Comme nous l'avons vu auparavant, Thomson pensait que l'atome était divisible et dont la structure est formée par une sphère positive et des électrons autour.
Échecs et limitations du modèle
À l'époque, le modèle atomique de Thomson a réussi à expliquer très bien le comportement chimique des substances. Il a également expliqué à juste titre les phénomènes qui se sont produits dans le tube de rayon de cathode.
Mais en fait, Thomson n'a même pas appelé ses particules "électrons", bien que le terme ait déjà été inventé par George Johnstone Stoney. Thomson les a simplement appelés "corpuscules".
Bien que Thomson ait utilisé toutes les connaissances qu'il avait pour le moment, il y a plusieurs limitations importantes dans son modèle, qui étaient évidentes très bientôt:
-La charge positive n'est pas distribuée dans tout l'atome. Les expériences de dispersion de Rutherford ont montré que la charge positive de l'atome se limite nécessairement à une petite région, qui est devenue plus tard connue sous le nom de noyau atomique.
-Les électrons ont une distribution spécifique dans chaque atome. Les électrons ne sont pas uniformément distribués, comme les raisins secs du célèbre Buddine, mais ont une disposition en orbitales que les modèles suivants ont montré.
C'est précisément la disposition des électrons dans l'atome qui permet d'organiser les éléments pour leurs caractéristiques et propriétés dans le tableau périodique. C'était une limitation importante du modèle Thomson, qui ne pouvait pas expliquer comment il était possible d'ordonner les éléments de cette manière.
-Le noyau atomique est celui qui contient la plupart de la pâte. Le modèle de Thomson a postulé que la masse de l'atome était uniformément distribuée à l'intérieur. Mais aujourd'hui, nous savons que la masse de l'atome est pratiquement concentrée dans les protons et les neutrons du noyau.
Il est également important de souligner que ce modèle d'atome n'a pas permis à déduire le type de mouvement que les électrons avaient dans l'atome.
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique broglie.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique de Dalton.
Modèle atomique de Dirac Jordan.
Modèle atomique démocrite.
Modèle atomique de leucipo.
Modèle atomique bohr.
Modèle atomique Sommerfeld.
Modèle atomique actuel.
Les références
- Andriessen, M. 2001. Cours HSC. Physique 2. Jacaranda HSC Science.
- Arfken, g. 1984. Physique universitaire. Presse universitaire.
- Chevalier, r. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique. Pearson.
- Rex, un. 2011. Fondamentaux de la physique. Pearson.
- Wikipédia. Modèle atomique Thomson. Récupéré de: c'est.Wikipédia.org.
- « Formule générale Équations quadratiques, exemples, exercices
- Modèle aomique des caractéristiques et postulats de Dirac Jordan »

