Caractéristiques, structure, types et fonction de la myosine
- 3371
- 147
- Jade Duval
La Myosine Il s'agit d'un moteur moléculaire, de nature protéique, capable de se déplacer sur des filaments d'actine dans le cytosol. L'énergie qui entraîne le déplacement de la myosine provient de l'hydrolyse de l'ATP. Pour cette raison, la myosine est généralement définie comme une enzyme de mécanochimie.
Chez les eucaryotes, la myosine est une protéine très abondante. Il existe différents types de myosine, qui sont codés par une famille de gènes. Dans les levures, 5 classes se distinguent, tandis que des dizaines ont été décrites chez les mammifères.
 Source: David Richfield (utilisateur: Slashme) Lorsque vous utilisez cette image dans des œuvres externes, il peut être cité comme suit: Richfield, David (2014). "Galerie médicale de David Richfield". Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Source: David Richfield (utilisateur: Slashme) Lorsque vous utilisez cette image dans des œuvres externes, il peut être cité comme suit: Richfield, David (2014). "Galerie médicale de David Richfield". Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] Myosin a une grande variété de fonctions. Myosin I, à côté de l'actine, participe au mouvement des kératocytes.
La myosine II assure une raideur à la membrane plasmique, participe à la cytokinèse et à la contraction musculaire. Les deux, Myosinas I et II, collaborent avec la migration cellulaire. Myosinas I et V effectuent le transport des vésicules le long des filaments d'actine.
[TOC]
Structure
Dans les micrographies électroniques, la structure d'isoforme myosine typique a trois domaines: la tête, le cou et la queue. Grâce à l'hydrolyse avec une chimotripsin, un segment composé de la tête et du cou, appelé méomiosine lourde (HMM), et un segment de queue, appelé méomiosine léger (LMM) est obtenu.
La maîtrise de la tête est l'extrémité N-terminale de la chaîne lourde, et le domaine de la queue est l'extrémité C-terminale de la chaîne légère.
Les classes de myosine peuvent être différenciées par le nombre de chaînes polypeptiques qui la composent, et l'abondance et la classe de chaîne légère se sont unis.
Myosin I a une chaîne polypeptidique, qui forme une tête et sa queue manque de régions hélicides alpha. Tandis que Myosinas I et V ont deux chaînes polypeptidiques, et là.
Myosinas I et V ont des sites syndicaux pour calmodulin, qui régule et répare CA+2, Dans les chaînes légères. La myosina j'ai réparé CA+2 Dans les chaînes légères, mais cela le fait différemment de la calmoduline.
Caractéristiques
Au niveau mécanique, les myosinas ont trois caractéristiques, à savoir:
- Le chef de la myosine est le domaine moteur qui progresse par des étapes discrètes: l'union de la myosine se dirige vers un filament d'actine, son inclination et sa séparation ultérieure produisent le mouvement de la myosine. Ce processus est cyclique et dépend de l'ATP.
- Changements de conformation: l'hydrolyse d'une molécule ATP est couplée à chaque étape d'une molécule de myosine, au moyen d'amplification et de niveaux de transmission. Cela implique de grands changements conformationnels de la myosine.
Peut vous servir: symétrie radialeLe premier niveau d'amplification est produit par la perte du groupe gamma-phosphate de l'ATP, qui permet une réorganisation des éléments structurels sur le site de l'ATP Union. Cette réorganisation est coordonnée avec des changements structurels dans le site d'union en actine.
Le deuxième niveau d'amplification implique la communication du changement conformationnel dans le site actif en composants structurels du terminal carboxyle.
- Directionnalité: il a été constaté que les miennes ont une polarité, ou une directionnalité inversée, vers la fin (+) du filament d'actine. Cette conclusion provient des expériences de nivellement du filament d'actine, en utilisant un microscope optique à fluorescence.
Les fonctions
La myosine, à côté de l'actine, participe à la contraction musculaire, à l'adhésion cellulaire, à la cytokinèse, à l'octroi de raideur aux membranes corticales et au déplacement de certaines vésicules, entre autres fonctions.
Les défauts de la myosine peuvent produire des conditions pathologiques. Par exemple, les défauts dans les myosines I et V sont liés, respectivement, avec des myopathies de la myosine et des troubles de la pigmentation (syndrome de Griselli). Tandis que les troubles des isoformes de myosine VI provoquent une perte de l'oreille.
Contraction musculaire
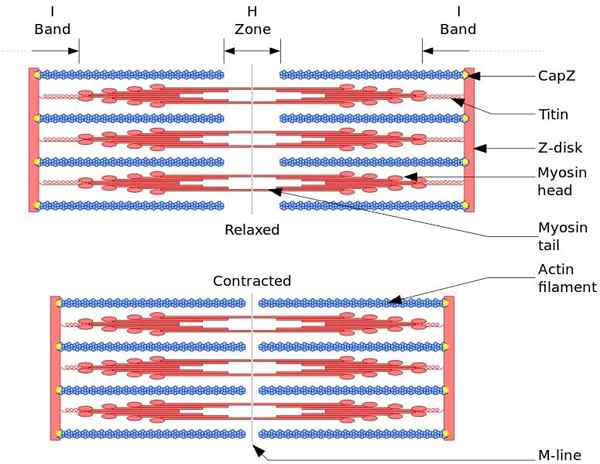
L'unité fonctionnelle et structurelle du muscle squelettique est sarcomro. Pendant la contraction musculaire, la longueur du sarcomère atteint 30% de sa longueur d'origine.
Les sarcomères sont constitués de filaments épais, de myosine et de minces actine, qui sont organisés de manière complexe. En général, les têtes de myosine sont situées aux extrémités distales du filament et de ses queues vers le centre du sarcomero, et l'organisation est bipolaire.
Pour faire la contraction musculaire, les têtes de myosine, des extrémités opposées, doivent se déplacer vers le disque z ou la fin (+) du filament. Parce que l'organisation de filaments épais est bipolaire, le glissement de filaments minces sur des filaments épais se produit, entraîné par l'ATP.
La force de déplacement se produit parce que des centaines de têtes de myosine, d'un filament épais, interagissent avec un filament mince.
Cytocicese
Pendant la mitose, lorsque les microtubules des pôles de broche sont séparés, l'actine et la myosine II forment un anneau contractile dans la cellule de la cellule. Cet anneau contracte son diamètre et divisant la cellule en deux parties.
Accordant une raideur aux membranes corticales
Dans les cellules mutantes qui manquent de myosine II, la membrane plasmique se déforme facilement lorsqu'une force externe est appliquée. Cela se produit parce que la myosine II fournit une force d'agrégation aux protéines de la membrane plasmique.
Peut vous servir: adaptation morphologiqueAdhérence cellulaire
Dans le tissu épithélial, les faisceaux actine contractile et la myosine II sont situés dans les quartiers de la membrane plasmique et forment une ceinture circulaire qui entoure la surface cellulaire cellulaire. Cette ceinture circulaire détermine la forme de la cellule et maintient l'union entre les cellules.
Le contact entre les cellules se produit par l'union circulaire de la courroie aux molécules d'adhésion cellulaire, en utilisant des protéines de liaison.
Déplacement de certaines vésicules
Des preuves expérimentales révèlent que la myosine V effectue le transport de la membrane de l'appareil Golgi à la périphérie de la cellule. Certaines preuves sont:
- Dans les cellules tissulaires nerveux, par immunofluorescence des astrocytes, il a été constaté que la myosine V est située à côté de Golgi.
- Chez les levures, les mutations du gène de la myosine V interrompent la sécrétion de protéines et, par conséquent, les protéines s'accumulent dans le cytosol.
- Les isoformes myosine I sont chargées de transporter des vacuolas vers la membrane cellulaire. En utilisant des anticorps spécifiques contre les isoformes de la myosine I, il a été constaté que ces isoformes sont situées dans différentes parties de la cellule.
Par exemple, lorsqu'une amibe vivante est marquée d'un anticorps contre la myosine IC, le transport de la vacuole vers la membrane est arrêté. Pour cette raison, la vacuole se développe et la cellule explose.
Maladies liées à la myosine
Myosinas et perte d'oreille
Il existe de nombreux gènes et mutations qui produisent la perte d'oreille. Cette maladie est souvent monogénétique .
Des mutations dans les myosinas non conventionnelles, avec une ou deux têtes de myosine, affectent le fonctionnement de l'oreille interne. Certaines des myosines mutées Isaformes sont la myosine IIIA, la myosine VIIA et la myosine XVA. Récemment, deux mutations ont été découvertes dans la myosine VI.
Les mutations de la myosine VI sont C.897g> T et P.926Q. La première mutation affecte une région qui interagit avec le situé actif, appelé commutateur I. Homozygotes pour la mutation précoce présente le phénotype, provoquant des effets graves.
La deuxième mutation affecte une région de charge avec charge, dans une hélice alpha dans la queue de la myosine VI. Cette région est importante pour la dimérisation proximale du moteur et affecte la fonction stéréo-Chart de la myosine VI.
Il peut vous servir: Sciences auxiliaires de la biologieUne autre mutation est p.ASN207SER, qui produit un moteur incapable de produire une résistance. En effet.
La mutation p.Arg657Trp produit la perte de la fonction de myosine VI. Le résidu ARG est impliqué dans les changements conformationnels qui attachent l'hydrolyse au mouvement de la myosine.
Myosine X et cancer
Myosina X (MyO10) est une myosine non conventionnelle qui s'exprime dans le cerveau, les endothélios et de nombreux épithéliums. MyO10 et trois types de projections basées sur l'actine (philopodes, factucides et projections similaires aux philopodiens) pendant les métastases du cancer.
Les cellules cancéreuses invasives ont un grand nombre de philopodes et expriment des niveaux élevés de fascin. Cette protéine fonctionne entre les filaments d'actine. Afin d'échapper à la tumeur primaire, des envaddies se forment, riches en activité protéolytique, qui digèrent la matrice extracellulaire environnante.
Une fois que les cellules atteignent la matrice extracellulaire, les projections similaires aux philopodes aident à se disperser et à coloniser. Des niveaux élevés de MYO10 indiquent une grande agressivité et des métastases dans le cancer du sein.
Le silençage de Myox produit la perte du caractère métastatique des cellules, qui ne sont pas en mesure de former des projections basées sur l'actine. Toutes ces projections ont des adhérences basées sur la compréhension, qui sont transportées par MY1010 dans le philopodium.
Myox est impliqué dans la formation des centres. L'absence de myox favorise la formation de pointes multipolaires. Myox est également impliqué dans la signalisation dans les cellules cancéreuses. Par exemple, Myox est activé par 3,4,5, -inositol trifosphate (PIP3).
Les références
- Alberts, B., Johnson, un., Lewis, J., et chou. 2007. Biologie de la cellule moléculaire. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, un., Karfunkel-Don, D., Sirigu, s., Davido, B., Shohat, m., Frydman, m., Houdusse, un., Kanaan, m., Avraham, k. 2014. Novory Myosin Mutations for Heréditary auditive RELLED par une capture génomique ciblée et un séquençage massivement parallèle. European Journal of Human Genetics, 22: 768 -775.
- Courson, D.S. et Cheney, R.ET. 2015. Myosine-x et maladie. Recherche de cellules expérimentales, 334: 10-15.
- Lodish, H., Berk, un., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie cellulaire et moléculaire. Éditorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexique, Sāo Paulo.
- Schliwa, m. et woehlke, g. 2003. Moteurs moléculaires. Nature, 422: 759 - 765.
- Valoir.D. 2003. La boîte à outils moléculaire pour le transport intacellulaire. Cell, 112: 467-480.
- « Caractéristiques, structure et fonctions d'exonucléase
- Bromo Historique, structure, configuration électronique, propriétés, utilisations »

