Bromo Historique, structure, configuration électronique, propriétés, utilisations

- 3335
- 16
- Prof Noah Collet
Il brome C'est un élément non métallique qui appartient au groupe halogènes, groupe 17 (viia) du tableau périodique. Son symbole chimique est le BR. Il est présenté comme une molécule diatomique, dont les atomes sont unis par une liaison covalente, de sorte que la formule moléculaire est attribuée2.
Contrairement au fluorure et au chlore, le brome dans des conditions terrestres n'est pas un gaz mais un liquide brun rougeâtre (image inférieure). C'est fumer, et c'est avec Mercure, les seuls éléments liquides. En dessous, l'iode, bien que sa couleur s'intensifie et devienne violet, peut se cristalliser dans un solide volatil.
 Flacon avec du brome liquide pur. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Flacon avec du brome liquide pur. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] Le Bromo a été découvert, indépendamment, en 1825 par Carl Löwig, qui a étudié sous la direction du chimiste allemand Leopold Gmelin; Et en 1826, par le chimiste français Antoine-Jerome Ballard. Cependant, la publication des résultats expérimentaux de Balard a précédé celui de Löwig.
Bromo est le 62e élément le plus abondant sur Terre, réparti à de faibles concentrations par le cortex terrestre. Dans la mer, la concentration moyenne est de 65 ppm. Le corps humain contient un brome 0,0004%, sans savoir définitivement sa fonction.
Cet élément est exploité commercialement dans les salmuelas ou les endroits qui, par des conditions spéciales, sont des sels élevés; Par exemple, la mer Morte, à laquelle les eaux des territoires voisins, saturés de sels convergent.
C'est un élément corrosif capable d'attaquer des métaux, comme le platine et le paladium. Dissous dans l'eau, le brome peut également exercer son action corrosive sur les tissus humains, aggravant la situation parce que l'acide bromhytérique peut être généré. En ce qui concerne sa toxicité, il peut endommager des organes importants, comme le foie, les reins, les poumons et l'estomac.
Le brome est très nocif dans l'atmosphère, étant 40 à 100 fois plus destructeur pour la couche d'ozone que le chlore. La moitié de la perte de la couche d'ozone en Antarctique est produite par des réactions liées au bromométhyle, composé utilisé comme fumigant.
Il a de nombreuses utilisations, telles que: retardateur d'incendie, agent de blanchiment, désinfectant de surface, additif de carburant, intermédiaire dans la fabrication sédative, dans la fabrication de produits chimiques organiques, etc.
[TOC]
Histoire
Carl Löwig Work
Le Bromo a été découvert indépendamment et presque simultanément par Carl Jacob Löwig, chimiste allemand en 1825, et par Antoine Balard, chimiste français en 1826.
Carl Löwig, disciple du chimiste allemand Leopold Gmelin, a collecté l'eau dans une source de mauvais kreuznach et a ajouté du chlore; Après l'ajout de l'éther, il a remué le mélange de liquides.
Ensuite, l'éther séparé par la distillation et l'a concentré par évaporation. En conséquence, il a obtenu une substance brune rougeâtre, qui était le brome.
Antoine Balard Travail
Balard, en revanche, a utilisé des cendres d'une algue brune. Ainsi, le bromo libéré, le chlore a traversé le matériau aqueux soumis à une extraction, dans lequel le bromure de magnésium, MGBR était présent2.
Par la suite, le matériau a été distillé en présence de dioxyde de manganèse et d'acide sulfurique, produisant des vapeurs rouges qui se condensaient dans un liquide foncé. Balard pensait que c'était un nouvel élément et l'appelait Muride, dérivé du mot latin muria, avec lequel la saumure a été désignée.
Il peut vous servir: la matière vivante: concept, caractéristiques et exemplesIl a été souligné que Balard a changé le nom de Muride en Bronme par la suggestion d'Anglada ou de Gay-Lussac, en fonction du fait que Brôme signifie pestilent, qui définit l'odeur de l'élément découvert.
Les résultats ont été publiés par Belard dans Annales of Chemie and Physique, avant que Löwig ne publie le sien.
Ce n'est qu'à partir de 1858, le brome a été produit en quantités importantes; année au cours de laquelle des dépôts de sel stassfurt ont été découverts et exploités, obtenant du brome.
Structure et configuration électroniques de Bromo
Molécule
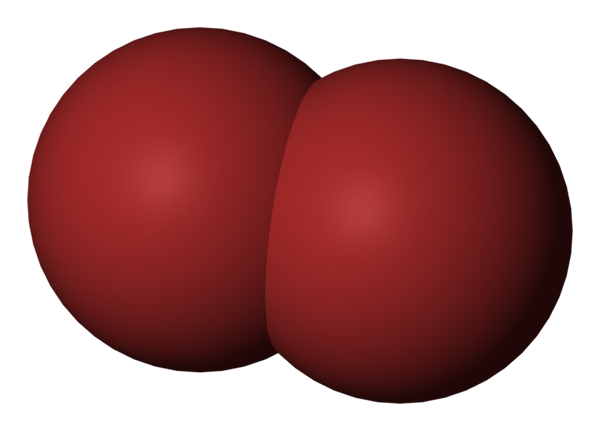 Molécule BR2. Source: Benjah-Bmm27 [domaine public].
Molécule BR2. Source: Benjah-Bmm27 [domaine public]. Dans l'image supérieure, la molécule de brome est montrée, Br2, Avec un modèle de remplissage compact. En fait, il y a une simple liaison covalente entre les deux atomes de brome, Br-Br.
Étant une molécule diatomique et homogène, elle manque de moment dipolaire permanent et ne peut interagir qu'avec d'autres du même type à travers les forces de dispersion de Londres.
C'est la raison pour laquelle votre liquide rougeâtre fume; Dans les molécules Br2, Bien qu'ils soient relativement lourds, leurs forces intermoléculaires les maintiennent faiblement liés.
Bromo est moins électronégatif que le chlore et exerce donc un effet d'attraction inférieur sur les électrons des couches de valence. En conséquence, il nécessite moins d'énergie pour parcourir des niveaux d'énergie plus élevés, absorber les photons verts et refléter une couleur rougeâtre.
Cristaux
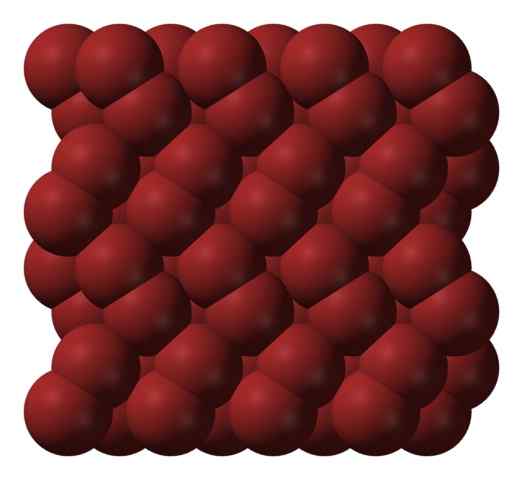 Structure cristalline bromo. Source: Ben Mills [domaine public].
Structure cristalline bromo. Source: Ben Mills [domaine public]. Dans une phase gazeuse, les molécules BR2 Ils se séparent considérablement jusqu'à ce qu'il y ait des interactions efficaces entre eux. Cependant, en dessous de son point de fusion, le brome peut être congelé en cristaux orthorrombiques rougeâtre (image supérieure).
Notez comment les molécules BR2 Ils sont positionnés ordonnés de telle manière qu'ils semblent "Bromine Worms". Ici et à ces températures (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Couche de valence et états d'oxydation
La configuration électronique du brome est:
[Ar] 3ddix4s2 4p5
Être 3Ddix4s2 4p5 sa couche de valence (bien que l'orbital 3Ddix N'ont pas d'importance dans vos réactions chimiques). Les électrons des orbitales 4s et 4p sont les plus à l'extérieur et ajoutent un total de 7, un seul électron pour compléter l'octet de Valence.
À partir de cette configuration, les états d'oxydation possibles peuvent être déduits pour le brome: -1, si un électron gagne un islectronique au Kripton; +1, étant comme la 3Ddix4s2 4p4; +3, +4 et +5, perdant tous les électrons de l'orbital 4p ([ar] 3Ddix4s24p0)); et +7, en cours d'exécution sans électrons dans l'orbital 4s ([ar] 3ddix4s04p0).
Propriétés
Aspect physique
Petit liquide rougeâtre brun foncé. Il se trouve dans la nature comme une molécule diatomique, avec des atomes unis par une liaison covalente. Bromo est un liquide plus dense que l'eau et s'enfonce dedans.
Peut vous servir: radio: structure, propriétés, utilisations, obtentionPoids atomique
79 904 g / mol.
Numéro atomique
35.
Odeur
Une fumée d'acre, suffocant et irritant.
Point de fusion
-7.2 ºC.
Point d'ébullition
58,8 ºC.
Densité (br2) liquide
3 1028 g / cm3
Solubilité dans l'eau
33,6 g / L A 25 ° C. La solubilité du brome dans l'eau est faible et a tendance à augmenter en diminuant la température; comportement similaire à d'autres gaz.
Solubilités
Librement soluble dans l'alcool, l'éther, le chloroforme, le tétrachlorure de carbone, le disulfure de carbone et l'acide chlorhydrique concentré. Soluble dans les solvants non polaires et certains polaires tels que l'alcool, l'acide sulfurique et dans de nombreux solvants halogénés.
Point triple
265,9 K à 5,8 kPa.
Point critique
588 K à 10,34 MPA.
Chaleur de fusion (br2)
10 571 kJ / mol.
Chaleur de vaporisation (br2)
29,96 kJ / mol.
Capacité calorique molaire (br2)
75,69 kJ / mol.
La pression de vapeur
À une température de 270 K, 10 kPa.
Température d'auto-signification
Pas inflammable.
point d'allumage
113 ºC.
Température de stockage
2 à 8 ºC.
Tension superficielle
40,9 MN / m A 25 ºC.
Seuil d'odeur
0,05 - 3,5 ppm. 0,39 mg / m3
Indice de réfraction (ηd)
1 6083 à 20 ºC et 1 6478 à 25 ºC.
Électronégativité
2.96 sur l'échelle Pauling.
Énergie d'ionisation
- Premier niveau: 1.139,9 kJ / mol.
- Deuxième niveau: 2.103 kJ / mol.
- Troisième niveau: 3.470 kJ / mol.
Radio atomique
120 h.
Radio-covalent
120 h 3.
Radio Van der Waals
185 h.
Réactivité
Il est moins réactif que le chlore, mais plus réactif que l'iode. C'est un oxydant moins fort que le chlore et plus fort que l'iode. C'est aussi un agent réducteur plus faible que l'iode, mais plus fort que le chlore.
La vapeur du chlore est très corrosive pour de nombreux matériaux et tissus humains. Il attaque de nombreux éléments métalliques, notamment le platine et le paladium; Mais il n'attaque pas le plomb, le nickel, le magnésium, le fer, le zinc et moins de 300 ºC soit au sodium.
Bromo dans l'eau éprouve un changement et se transforme en bromure. Il peut également exister en tant que bromate (frère3-), Selon le pH liquide.
En raison de son action oxydante, le brome peut induire la libération de radicaux sans oxygène. Ce sont de forts oxydants et peuvent causer des lésions tissulaires. De plus, le brome peut produire un allumage spontané lorsqu'il est combiné avec du potassium, du phosphore ou de l'étain.
Applications
Additif à essence
Le dibromure d'éthylène a été utilisé pour éliminer les éventuels dépôts de plomb dans les moteurs des voitures. Après la combustion de l'essence, qui a utilisé le plomb comme additif, le brome combiné avec le plomb pour former du bromure de plomb, un gaz volatil qui a été expulsé par le tube d'échappement.
Alors que le brome a éliminé l'avance de l'essence, son action destructrice sur la couche d'ozone était très puissante, c'est pourquoi elle a été jetée pour cette application.
Pesticides
Le méthylène ou le bromode de bromométhyle a été utilisé comme pesticide pour purifier les sols, en particulier pour éliminer les nématodes parasites, comme n'importe qui.
Cependant, l'utilisation de la plupart des composés contenant du brome a été rejetée, encore une fois, destructrice sur la couche d'ozone.
Contrôle d'émission de mercure
Bromo est utilisé dans certaines plantes pour réduire les émissions de mercure, le métal très toxique.
Peut vous servir: Gravimétrie: analyse gravimétrique, méthodes, utilisations et exemplesLa photographie
Le bromure d'argent, en plus du yoduro en argent et du chlorure d'argent, est utilisé comme un composé sensible à la lumière dans les émulsions photographiques.
Actions thérapeutiques
Le bromure de potassium, ainsi que le bromure de lithium, ont été utilisés comme sédatifs généraux au 19e siècle et le début du XXe siècle. Les sels simples sont encore utilisés dans certains pays tels que les anticonvulsions.
Cependant, la FDA américaine n'approuve pas l'utilisation du brome pour le traitement d'une maladie aujourd'hui.
Ralentissement
Le brome est transformé par les flammes en acide bromhorique, qui interfère avec la réaction d'oxydation qui se produit pendant le feu et produit son extinction. Les polymères contiennent du brome sont utilisés pour faire des résines de retard de feu.
Additif alimentaire
Des traces de bromate de potassium à la farine ont été ajoutées pour améliorer sa cuisson.
Réactifs chimiques et intermédiaire
Le bromure d'hydrogène est utilisé comme agent réducteur et catalyseur pour les réactions organiques. Bromo est utilisé comme intermédiaire chimique dans la fabrication de médicaments, de liquides hydrauliques, d'agents réfrigérants, de déshumidificateurs et en préparations des cheveux ondulés.
Il trouve également une utilisation dans l'élaboration des fluides de forage de puits, des produits pour la désinfection de l'eau, des agents blanchâtres, des désinfectants de surface, des colorants, des additifs de carburant, etc.
Action biologique
Une étude menée en 2014 indique que le brome est un cofacteur nécessaire pour la biosynthèse du collagène IV, ce qui fait du brome un élément essentiel pour le développement des tissus animaux. Cependant, il n'y a aucune information sur les conséquences d'un déficit de l'élément.
Où est-il situé
Bromo est extrait commercialement des mines de sel et des puits profonds de salmuelas trouvés dans l'État de l'Arkansas, et dans le grand lac salé de l'Utah, tous deux aux États-Unis. Cette dernière saumure a une concentration de brome 0,5%.
Pour extraire le brome.
La mer Morte, à la frontière entre la Jordanie et Israël, est une mer fermée qui est sous le niveau de la mer, ce qui en fait une très forte concentration de sels.
Bromo et Potassa y sont obtenus commercialement, par évaporation de l'eau avec un sel élevé de la mer Morte. Dans cette mer, la concentration de brome peut atteindre 5 g / L.
On le trouve également à des concentrations élevées dans certaines sources chaudes. La Bominita, par exemple, est un minéral de bromure d'argent trouvé en Bolivie et au Mexique.
Des risques
Le brome à l'état liquide est corrosif pour les tissus humains. Mais le plus grand danger pour l'homme vient de vapeurs de brome et d'inhalation.
Respirez dans un environnement avec une concentration de brome de 11 à 23 mg / m3 Il produit de graves chocs. Une concentration de 30 à 60 mg / m3 C'est extrêmement nocif. Pendant ce temps, une concentration de 200 mg peut être fatale.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Centre national d'information sur la biotechnologie. (2019). Brome. Base de données PubChem. CID = 23968. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Ross Rachel. (8 février 2017). Faits sur le brome. Récupéré de: LiveScience.com
- Wikipédia. (2019). Borax. Récupéré de: dans.Wikipédia.org
- Lentech b. V. (2019). Brome. Récupéré de: lentech.com
- « Caractéristiques, structure, types et fonction de la myosine
- Caractéristiques, structure, types et fonctions nucléas »

