Caractéristiques, structure, fonctions de la myéloperoxydase
- 2746
- 82
- Prof Noah Collet
La myéloperoxydase Il s'agit d'une hémoprotéine avec une activité enzymatique oxydortée qui fonctionne dans différentes cellules du système immunitaire dans le combat des micro-organismes envahisseurs et dans d'autres processus cellulaires.
Cette peroxydase lysosomale se trouve dans les granulocytes et les monocytes des mammifères et des fonctions d'exercices dans le système de microbicide dépendant du peroxyde d'hydrogène des neutrophiles, faisant partie des composants de la réponse immunitaire innée.
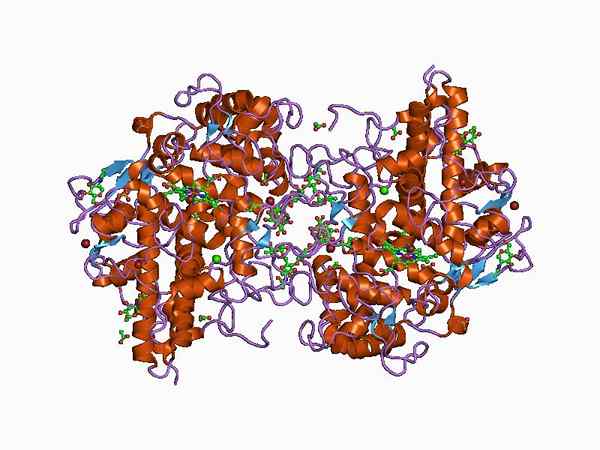
 Représentation de la structure de l'enzyme de la myéloperoxydase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons)
Représentation de la structure de l'enzyme de la myéloperoxydase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) Il a d'abord été décrit par Agner, qui a inventé le terme initial de "verdoperoxydase", car il s'agit d'une enzyme avec une couleur verte caractéristique.
Quelque temps plus tard, son nom a été changé en myéloperoxydase, car il s'agit d'une enzyme caractéristique des cellules appartenant aux lignées myéloïdes de la moelle osseuse et présente dans différents tissus conjonctifs du corps de certains animaux.
En plus de ses fonctions dans le système immunitaire pour le combat des micro-organismes envahisseurs, les produits des réactions catalysés par la myéloperoxydase causent des lésions tissulaires pendant différentes réactions inflammatoires.
Son activité a également été liée à l'évolution de certaines maladies cardiovasculaires et pendant les phases d'initiation, de propagation et de complication des processus athérosclérotiques, qui est exploité pour le diagnostic et l'intervention thérapeutique de ces pathologies.
[TOC]
Caractéristiques
La fonction catalytique de la myéloperoxydase est basée sur l'oxydation de deux électrons de la clanage, pour réaliser la formation de hocl ou d'acide hypochlore qui, lorsqu'il est ingéré par les organismes vivants, est toxique et peut même être mortel.
Cette enzyme est particulièrement abondante dans les granules azurophiles primaires dans le cytoplasme des leucocytes polymorphonucléaires, où il représente plus de 3% du poids de ces cellules. Il se trouve également dans les monocytes humains, mais pas dans les macrophages tissulaires.
Il peut vous servir: classification Woese (système de domaine 3)La myéloperoxydase est codée par un gène 2.200 paires de bases (2.2 kb), qui est responsable de la synthèse d'un peptide précurseur de 745 déchets aminés.
Chez l'homme, ce gène est situé sur le chromosome 17, dans la région 12-23 du bras long et contient 12 exons et 11 introns.
La synthèse de cette protéine se produit au stade promelocytaire de la différenciation des cellules de lignée myéloïde et leur traitement post-traductionnel se produit entre le réticulum endoplasmique, le complexe de Golgi et la membrane plasmique.
L'incorporation du groupe prothétique hémo se produit indépendamment du traitement post-traductionnel de la protéine précurseur inactive.
Structure
La myéloperoxydase est synthétisée comme une protéine précurseur glycosylée (avec des portions de glucides) d'environ 90 kDa. Ceci est ensuite divisé pour former deux chaînes: une lourde (55-60 kDa) et une lumière (10-15 kDa).
La protéine mature est composée de deux chaînes lourdes et deux légères, formant un tétler de 120 à 160 kDa, avec deux groupes prothétiques identiques dans chaque tétrous.
La chaîne lourde a 467 acides aminés et se trouve à l'extrémité C-terminale de la protéine, tandis que la chaîne légère est composée de 108 déchets.
Dans les leucocytes polymorphonucléaires, au moins trois isoformes de cette enzyme ont été décrites, connues sous le nom de I, II et III et dans les cellules promilocytiques tumorales HL-60 (cellules précurseurs) quatre ont été décrites quatre, nommées AI, IB, II et III.
Les myéloperoxydases de type I, II et III des polymorphonucléaires ont des poids moléculaires de 120, 115 et 110 kDa, respectivement et leur composition d'acides aminés ne varie pas considérablement. Ils ont une proportion élevée en aspartate, au glutamate, à la leucine et aux déchets de proline, ainsi qu'à l'aminoazúcar N-acétylglucosamine dans la partie Sacararida.
Peut vous servir: oxydation bêta des acides gras: étapes, réactions, produits, régulationLe groupe prothétique de ces enzymes contient des atomes de fer et la teneur en ce métal varie en fonction des espèces animales qui sont étudiées. On pense que ce groupe est lié de manière covalente aux lourdes sous-unités de la structure, ce qui est important pour l'activité enzymatique.
Les fonctions
La myéloperoxydase fait partie de ce qui est connu le «système de myéloperoxydase» et agit pendant la phagocytose des micro-organismes envahisseurs, qui s'accompagne de diverses réactions oxydatives, faisant partie des vacuoles phagocytiques.
Ce système de myéloperoxydase est impliqué dans l'élimination des bactéries, des virus, des parasites et des champignons.
Les composants du système sont une enzyme de myéloperoxydase, du peroxyde d'hydrogène et un facteur oxydable tel qu'un haluro. Le peroxyde d'hydrogène est produit pendant la respiration à travers des superxydes intermédiaires anions.
Ce peroxyde est capable de réagir avec la myéloperoxydase pour former ce qui est connu sous le nom de composé I, qui peut "attaquer" des haluros différents. Lorsque le composé, je réagit avec d'autres molécules de donneur d'électrons, il devient composé II, mais cela n'est pas en mesure de réagir avec Haluros.
Les haluros que le composé que j'utilise peuvent être des chlorures, des bromures, des iodures et le pseudo haluro tiocianato; Le plus courant pour ces enzymes, selon les expériences In vivo, Ce sont les chlorures qui, une fois traités par la myéloperoxydase, sont transformés en acide hypochloreux et autres dérivés, qui sont de puissantes molécules "germicide".
D'autres réactions catalysées par la même enzyme produisent des radicaux hydroxyles libres, des atomes d'oxygène "singulet", qui ne sont rien de plus que des atomes d'oxygène dans un état excité et ozone (O3), tous avec des activités bactéricide.
Il peut vous servir: lia gél (iron lysine): qu'est-ce que la fondation, la préparation, les utilisationsDans le développement des maladies
L'enzyme de myéloperoxydase est impliquée dans la promotion et la propagation de l'athérosclérose, car elle amplifie le potentiel oxydatif du peroxyde d'hydrogène en produisant de puissants oxydants capables d'affecter différents composés phénoliques.
Ces espèces réactives sont impliquées dans l'apparition de lésions tissulaires qui se produisent dans une variété de conditions inflammatoires.
L'augmentation des niveaux systémique de cette enzyme est utilisée comme marqueur diagnostique de l'existence de maladies coronariennes et d'autres affections cardiaques importantes.
En plus de leur relation avec certaines maladies cardiaques, les défauts de la myéloperoxydase se traduisent également par des conditions pathologiques immunitaires, car les défauts de leur activité bactéricide peuvent entraîner des infections systémiques dangereuses et aiguës.
Les références
- Kimura, s., & Ikeda-Saito, m. (1988). Myeloperoxydae humain et peroxydase thyroïdienne, deux enzymes avec des fonctions physiologiques distinctes et distinctes, sont des membres liés à l'évolution de la même famille de gènes. Protéines: structure, fonction et bioinformatique, 3, 113-120.
- Klebanoff, s. J. (1999). Myéloperoxydae. Systèmes antimicrobiens phagocytaires, 111(5), 383-389.
- Klebanoff, s. J. (2005). Myeloperoxidae: Ami et ennemi. Journal of Leucocyte Biology, 77, 598-625.
- Koffler, P., Ranyard, J., & Pertcheck, m. (1985). Myeloperoxydae: sa structure et sa expression lors de la différenciation myéloïde. Sang, 65(2), 484-491.
- Nicholls, s. J., Hazen, s. L., Nicholls, s. J., & Hazen, s. L. (2005). Myeloperoxydae et maladies cardiovasculaires. Artériosclérose, thrombose et biologie vasculaire, 25, 1102-1111.
- Tobler, un., & Koefter, h. P. (1991). Myeloperoxydae: localisation, structure et fonction. Dans Biochimie des cellules sanguines (PP. 255-288). New York: Plenum Press.
- « Révolution de 1830 causes, caractéristiques, conséquences
- Fonctionnement enzymatique et exemples »

