Mélange de ranques quiraral, exemples
- 1123
- 189
- Prof Noah Collet
Ongle Mélange de racmi o Les ratmatiques sont celles composées de deux énantiomères à parts égales et sont donc optiquement inactifs. Cette activité optique fait référence à la capacité de ses solutions à tourner, dans un horaire ou un anti-ameuble, un faisceau de lumière polarisée qui les traverse dans une direction.
Un énantiomère a la capacité de faire pivoter la lumière polarisée, par exemple, à gauche (Levógiro), donc sa solution pure sera optiquement active. Cependant, si cela commence à ajouter l'énantiomère qui tourne la lumière à droite (dextrogyrie), son activité optique diminuera jusqu'à ce qu'elle soit inactivée.
 Clusters de raisin, qui partagent une parenté avec des mélanges de ranques au-delà de l'étymologie. Source: Pexels.
Clusters de raisin, qui partagent une parenté avec des mélanges de ranques au-delà de l'étymologie. Source: Pexels. Lorsque cela se produit, il est dit qu'il existe les mêmes quantités des énantiomères Levogiro et Dextrógiro; Si une molécule a brisé la lumière polarisée vers la gauche, son effet sera annulé immédiatement lorsqu'il est "trébuché" avec une autre molécule qui le fait tourner vers la droite. Et ainsi de suite. Par conséquent, nous aurons un mélange rankic.
La première observation d'amélioration a été faite par le chimiste français Louis Pasteur en 1848, qui a étudié un mélange de cristaux énantiomériques d'acide tartrique (à ce moment-là appelé acide ranque). Lorsque cet acide des raisins utilisé pour la production de vin, ce mélange a fini par s'appliquer de manière générale pour toutes les molécules.
[TOC]
Chaussures et chiralité
En premier lieu, il y a un mélange de raisonnement, il doit y avoir deux énantiomères (ordinaires), ce qui implique que les deux molécules sont des chirales et que leurs images miroir ne sont pas chevronnées. Une paire de chaussures l'illustre parfaitement: peu importe combien la chaussure de gauche est tentée à droite, elles ne peuvent jamais s'adapter.
Peut vous servir: acide faibleLa chaussure droite, pour dire, détourne la lumière polarisée vers la gauche; tandis que la chaussure de gauche le fait à droite. Dans une solution hypothétique où les chaussures sont les molécules, s'il n'y a que des chaussures de droits, des chiraux, cela sera optiquement actif. De la même manière, cela se produira s'il n'y a que des chaussures laissées en solution.
Cependant, s'il y a mille chaussures à gauche mélangées à mille chaussures de droits, il y a alors un mélange de ranque, qui est également optiquement inactif, car les écarts subis par la lumière à l'intérieur sont annulés mutuellement.
Si au lieu de chaussures c’était des balles, des objets qui sont aquiraux, il serait impossible d’exister des mélanges de rang, car ils ne pourraient même pas exister en tant que paires énantiomères.
Exemples
Acide tartrique
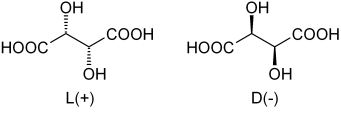 ÉNANTIMERS D'ACIDE TARTIQUE. Source: dschanz [domaine public]
ÉNANTIMERS D'ACIDE TARTIQUE. Source: dschanz [domaine public] De retour à l'acide tartrique, son mélange de ranques a été le premier à se rencontrer. Dans l'image supérieure, ses deux énantiomères sont représentés, chacun capable de former des cristaux avec des visages morphologiques de "gauche" ou "droite". Pasteur, en aidant un microscope et un effort rigoureux, a réussi à séparer ces cristaux énantiomères les uns des autres.
Les cristaux des énantiomères l (+) et d (-) séparément, présentent une activité optique en détournant la lumière polarisée vers la droite ou la gauche, respectivement. Si les deux cristaux dans les mêmes proportions molaires se dissolvent dans l'eau, un mélange de ranques optiquement inactif sera obtenu.
Notez que les deux énantiomères ont deux carbones chiraux (avec quatre substituants différents). Dans le L (+), les OH sont derrière le plan formé par le squelette de carbone et les groupes COOH; Tandis que dans d (-), ces oh sont au-dessus de ce plan.
Ceux qui synthétisent l'acide tartrique obtiendront un mélange de ranques. Pour séparer l'énantiomère l (+) de d (-), une résolution quirale est nécessaire, dans laquelle ce mélange est réagi avec une base chirale pour produire des sels diasteroisomères, capables de se séparer alors par cristallisation fractionnaire.
Peut vous servir: sulfure de cuivre: structure, propriétés, utilisationsQuinine
 Squelette structurel de la molécule de quinine. Source: Benjah-bmm27.
Squelette structurel de la molécule de quinine. Source: Benjah-bmm27. Dans l'exemple précédent, pour désigner un mélange de ranques d'acide tartrique, il est généralement écrit comme acide (±) -tartarique. Ainsi, dans le cas de la quinine (image supérieure), ce sera (±) -quinina.
L'isoméria de la quinine est complexe: elle a quatre carbones chiraux, donnant naissance à seize diasteroisomères. Fait intéressant, deux de ses énantiomères (l'un avec le OH au-dessus de l'avion et l'autre en dessous), sont en fait des diasthesomères, car ils diffèrent dans les configurations de leurs autres carbones chiraux (ceux du vélo avec l'atome n de n).
Maintenant, il est difficile de spécifier lequel des stéréoisomères de la quinine détournera la lumière polarisée vers la droite ou vers la gauche.
Talidomide
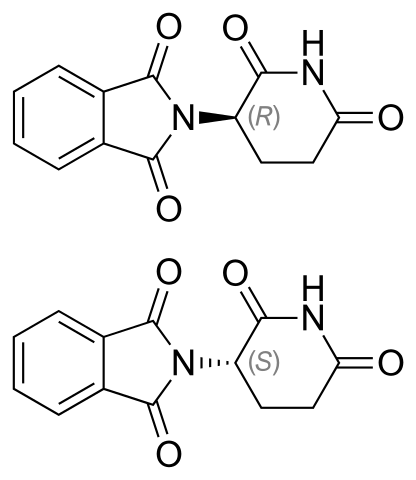 ÉNANTIMERS TALAIDOMIDE. Source: Vaccinationniste [Domaine public]
ÉNANTIMERS TALAIDOMIDE. Source: Vaccinationniste [Domaine public] Les énantiomères talidomide sont indiqués ci-dessus. Il n'a qu'un carbone Quiral: celui qui est lié à l'azote qui rejoint les deux anneaux (l'un de Phthalimida et l'autre du gluteramide).
Dans l'énantiomère R (avec des propriétés sédatifs), l'anneau phtalimida (celui de gauche) est orienté au-dessus du plan; tandis que dans les énantiomères (avec des propriétés mutagènes), ci-dessous.
Le pourcentage des deux n'est pas connu, lequel des deux détourne la lumière vers la gauche ou la droite. Ce que l'on sait, c'est qu'un mélange 1: 1 ou 50% des deux énantiomères forme le mélange de ranques (±) -talidomide.
Si vous voulez seulement commercialiser le talidomide en tant que sédatif hypnotique, il est obligatoire de soumettre son mélange de ranques à la résolution chirale déjà mentionnée, de sorte que l'énantiomère pur est obtenu.
Peut vous servir: Composés quaternaires: caractéristiques, formation, exemples1,2-époxipropane
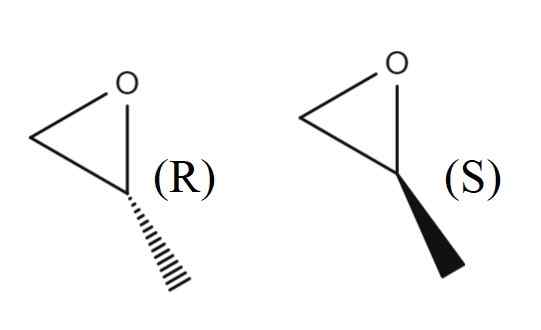 Énantiomères 1,2-époxipropane. Source: Gabriel Bolívar.
Énantiomères 1,2-époxipropane. Source: Gabriel Bolívar. Dans l'image supérieure, vous avez la paire d'énantiomères de 1,2 époxipropano. L'énantiomère r détourne la lumière polarisée vers la droite, tandis que le S le détourne vers la gauche; C'est-à-dire que le premier est le (r) - (+) - 1,2-époxipropano, et le second (s) - (-) - 1.2-époxipropano.
Le mélange rankic d'entre eux deux, encore une fois, dans un rapport 1: 1 ou 50%, devient (±) -1,2-époxipropane.
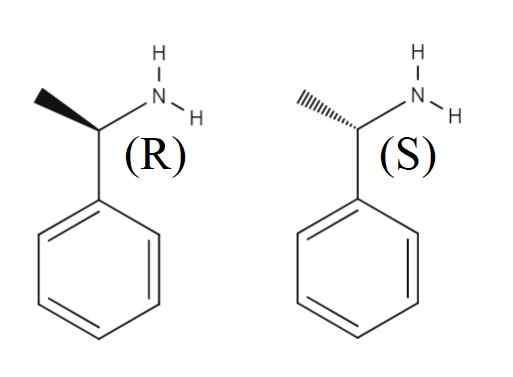
1-phényléthylamine
 Énantiomères de la 1 pényléthylamine. Source: Gabriel Bolívar.
Énantiomères de la 1 pényléthylamine. Source: Gabriel Bolívar. Supérieur Un autre mélange de ranques formé par les deux énantiomères de la 1-fenilléthylamine est montré. L'énantiomère r est (r) - (+) - 1-phényléthylamine et énantiomère s (s) - (-) - 1-feniletilamine; On a le groupe méthyl, Cho3, pointant à l'extérieur du plan d'anneau aromatique, et l'autre pointant sous ce.
Notez que lorsque la configuration est R, elle coïncide parfois avec le fait que l'Enantiómero tourne la lumière polarisée vers la droite; Cependant, il ne s'applique pas toujours et ne peut pas être considéré comme une règle générale.
Commentaire final
Plus important que l'existence ou non des mélanges ranques est la résolution chirale de la même. Cela s'applique particulièrement aux composés ayant des effets pharmacologiques qui dépendent d'un tel stéréoisome; C'est-à-dire qu'un énantiomère peut être bénéfique pour le patient, tandis que l'autre peut l'affecter.
C'est pourquoi ces résolutions chirales sont recourts à séparer les mélanges de rangs dans leurs composants, et peuvent donc les commercialiser comme des médicaments purs exempts d'impuretés nocives.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Steven A. Hardinger. (2017). Glossaire illustré de la chimie organique: mélange racémique. Département de chimie et de biochimie, UCLA. Récupéré de: Chem.Ucla.Édu
- Nancy Devino. (2019). Mélange racémique: définition et exemple. Étude. Récupéré de: étudier.com
- James Ashenhurst. (2019). Stéréochimie et chiralité: qu'est-ce qu'un mélange racémique? Récupéré de: MasterOganicchemistry.com
- John C. Leffingwell. (2003). Chiralité et bioactivité I.: Pharmacologie. [PDF]. Récupéré de: Leffingwell.com

