La moitié de mon What Is, Foundation, Préparation, utilise
- 3191
- 371
- Paul Dumas
Il Ma moitié Il s'agit d'un test biochimique qui est utilisé pour aider à l'identification des espèces de bactéries appartenant à la famille d'entérobactériafe. Il est assez nutritif et est composé de glucose, d'extrait de levure, de peptone, de tripeine, de chlorhydrate de l -ornitine, de bromocresh et de violet d'agar.
La signification de son acronyme (mien) décrit chacun des paramètres qui peuvent être observés dans ce support; Motilité, indol et ornitine. La motilité est la capacité du micro-organisme à se déplacer autour de la présence de flagelles. Pour que cette propriété soit observée, la cohérence du milieu doit être semi-solide, de sorte que la préparation porte moins d'agar.
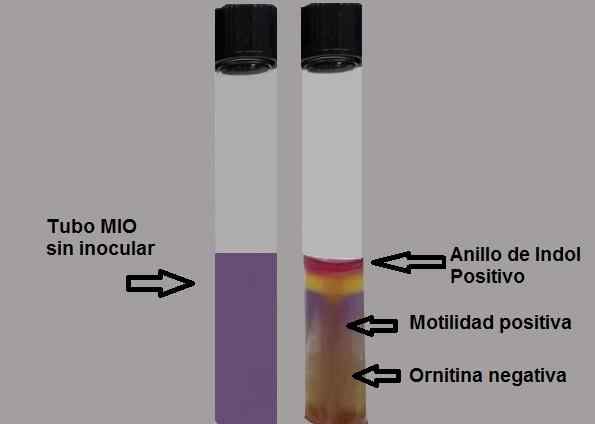
 Schéma d'interprétation des résultats dans la mine moyenne. Source: Préparé par l'auteur MSC. Marielsa Gil
Schéma d'interprétation des résultats dans la mine moyenne. Source: Préparé par l'auteur MSC. Marielsa Gil La production indol fait preuve de la présence de l'enzyme triptofanasa qui agit sur l'acide aminé tryptophane, étant nécessaire pour utiliser un réactif révélateur pour rendre visible la production d'Indole.
Enfin, Ornithine détermine si les bactéries sont capables de décarboxillary.
Base
Peptone, extrait de levure et triptein
Ces éléments contribuent au pouvoir nutritionnel de ce milieu. Ils servent de source de nutriments essentiels et d'acides aminés pour le développement bactérien.
De plus, le triptein est une source de tryptophane pour démontrer la présence de l'enzyme triptofanasa, qui dégrade le tryptophane dû.
L'INDOL est incolore, donc sa présence est révélée en ajoutant cinq gouttes du réactif d'Ehrlich ou de Kovacs, tous deux avec P-diméthylaminobenzaldéhyde.
Le groupe aldéhyde de ce composé réagit avec l'Indol, générant un produit en forme de rouge fuchsia à la surface de l'agar.
Tout vestige de couleur doit être considéré comme un test positif. Le test doit être lu immédiatement, car la couleur se dégrade.
D'un autre côté, ce test doit être révélé après avoir noté les résultats de la motilité et de la décarboxylation de l'ornithine.
Peut vous servir: os compact: caractéristiques, structure, fonctionsInterprétation
Test positif: Formation d'un anneau rouge fuchsia lors de l'ajout du réactif Kovacs gouttes.
Test négatif: Il n'y a pas de formation de ring.
Motilité
La capacité de mouvement de la bactérie sera la preuve.
Un test de motilité négatif sera mis en évidence en observant une fine ligne de croissance, et tout ce qui se trouvera sera sans croissance.
Il est important que la motilité soit lue avant de révéler.
Dans les bactéries mobiles mais en croissance lente, il est difficile de démontrer sa motilité avec ce milieu. Dans ce cas, il est recommandé d'utiliser d'autres tests ou méthodes, tels que la motilité moyenne ou la méthode de chute en attente.
Glucose
Le glucose est des glucides fermentesables qu'en plus de fournir de l'énergie acidifie le milieu, une condition nécessaire pour que la décarboxylation de l'acide aminé d'ornithine puisse se produire.
La fermentation du glucose doit toujours se produire, sur la base du principe que toutes les bactéries appartenant à la famille Enterobacteriaceae ferment le glucose.
L -ornitin
Dans le cas où les bactéries produisent l'enzyme d'ornitine décarboxylase, elle peut agir une fois que le milieu a été acidifié par la fermentation du glucose.
L'enzyme ornithine décarboxylase agit sur le groupe carboxyle de l'acide aminé produisant une amine appelée putresina qui alkheies à nouveau.
Ce test doit être lu après 24 heures d'incubation, car si vous essayez de lire avant de pouvoir mal comprendre le test avec un faux négatif.
N'oubliez pas que la première réaction qui se produit est la fermentation du glucose, de sorte que le milieu devient jaune en une phase initiale (10 à 12 heures). Si la décarboxylation de l'ornithine se produit plus tard, le milieu deviendra violet.
Il est important d'interpréter le test de décarboxylation de l'ornithine avant de révéler l'Indole, car l'agrégat du réactif Kovac modifie la couleur du milieu.
Peut vous servir: les royaumes de la nature et ses caractéristiquesInterprétation
Test négatif: Jaune ou jaune.
Test positif: la moitié complètement violette.
Indicateur de pH
Dans ce cas, Bromocresol Purple est utilisé; la personne responsable de révéler quand il y a un changement de pH au milieu. Par acidification, l'indicateur devient jaune, et quand les alcalinaires deviennent violets.
Technique semée et révélée
Pour semer le milieu de la mienne, une out aiguille est utilisée et une partie de la colonie à étudier est collectée avec elle.
Une ponction profonde est faite dans mon milieu en ligne droite. Ce n'est pas conseillé.
Incuber pendant 24 à 48 heures à 37 ° C dans l'aérobiose. Observez les résultats dans cet ordre: motilité, décarboxylation de l'ornithine et enfin révéler l'Indole.
Il est conseillé de prendre 2 ml sur le milieu, de le transférer dans un tube stérile et d'y effectuer le test indole là-bas, donc s'il donne négatif, le reste du tube d'origine peut être incubé pendant 24 heures de plus, pour révéler à nouveau l'Indole.
Le développement de l'Indole se fait comme suit: 3 à 5 gouttes du réactif Kovacs sont ajoutées dans mon environnement et les agitations fortement. On observe si un anneau rouge fuchsia apparaît ou non.
préparation
Ma moitié
Peser 31 GR de mon environnement et dissoudre dans un litre d'eau distillée.
Chauffer jusqu'à bouillir le mélange pendant une minute, en remuant fréquemment jusqu'à ce que vous dissoudiez complètement l'agar. Distribuez 4 ml du milieu dans des tubes à essai 13/100 avec couvercle de coton.
Stériliser en autoclave à 121 ° C pendant 15 minutes. Retirer de l'autoclave et laisser reposer droit sous un choc, de sorte qu'un taco semi-solide se forme.
Stocker dans un réfrigérateur de 2-8 ° C. Laisser un tempérament avant de semer la tension bactérienne.
La couleur du milieu déshydraté est beige et celle du milieu préparé violet légèrement opalescent.
Il peut vous servir: évolution divergente: causes et exemplesLe pH final du milieu préparé est de 6,5 ± 0.2
Le milieu devient jaune avec un pH acide et est violet à pH alcalin.
Kovacs réactif (développeur d'essai indol)
Ce réactif est préparé comme suit:
150 ml d'alcool amyl, isoamyl ou butyle sont mesurés (n'importe lequel des trois). 10 GR de p-diméthylaminobenzaldéhyde se dissolve dedans. Par la suite, 50 ml d'acide chlorhydrique concentré sont lentement ajoutés.
Le réactif préparé est incolore ou jaune transparent. Il doit être stocké dans une bouteille ambrée et conservé au réfrigérateur. Une couleur brun foncé montre sa détérioration.
Le réactif Kovacs peut également être remplacé par le réactif d'Ehrlich. Ce dernier, car il est plus sensible, est préféré pour révéler l'Indol dans les bactéries qui le produisent en quantité minimale, comme dans certains bacilles négatifs non fermentants et certains anaérobies.
Utiliser
Ce milieu est un test qui complète une batterie de tests biochimiques pour l'identification des bactéries appartenant à la famille Enterobacteriace.
Les données de décarboxylation de l'ornithine servent à différencier Shigella Sonnei, qui donne positif, de Shigella Boydii, Shigella Flexneri et S. Dysenterieae, Ils donnent négatif.
Il différencie également le genre Klebsiella, qui donne négatif, du genre Enterobacter, où la plupart de ses espèces donnent.
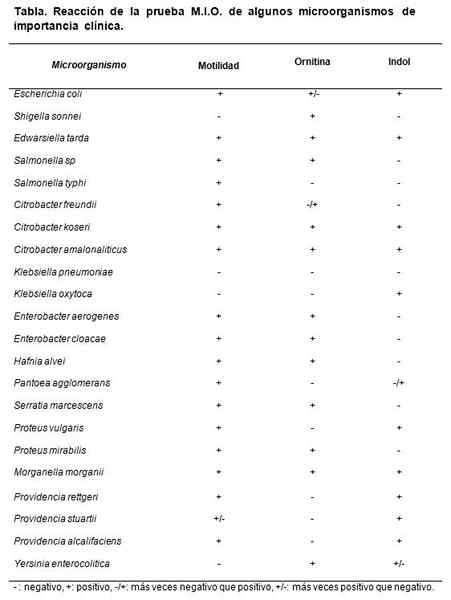 Source: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e ed. Pan -American Editorial S.POUR. Argentine.
Source: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e ed. Pan -American Editorial S.POUR. Argentine. Contrôle de qualité
Chaque fois que la moitié de la mienne est préparée, un test de contrôle peut être effectué. Pour cela, des souches connues ou certifiées sont utilisées pour observer le comportement du support.
Les souches qui peuvent être utilisées sont Escherichia coli, Morganella Morganii, Klebsiella Pneumoniae, Enterobacter Aerogenes et Proteus mirabilis.
Les résultats attendus sont ET. coli et m. Morganii. Dan M: +, i: + et o: +.
Klebsiella pneumoniae Donnez tout négatif (m: -, i: -, o :-). Proteus mirabilis et Enterobacter Aerogenes Dan M: + i: - et o: +.
Les références
- Mac Faddin J. (2003). Tests biochimiques pour l'identification des bactéries d'importance clinique. 3e édition. Éditorial Pan-American. Buenos Aires. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.

