Lois stoichiométriques

- 1997
- 393
- Louna Baron
Quelles sont les lois stoichiométriques?
Les lois stoichiométriques décrivent la composition de différentes substances, basées sur des relations (de masse) entre chaque espèce impliquée dans la réaction.
Toutes les matières existantes sont formées par la combinaison, dans différentes proportions, des différents éléments chimiques qui composent le tableau périodique. Ces syndicats sont régis par certaines lois combinées appelées lois de stœchiométrie ou poids de chimie.

Ces principes sont un élément fondamental de la chimie quantitative, étant indispensable pour l'équilibre des équations et pour des opérations aussi importantes, telles que la détermination des réactifs nécessaires pour produire une réaction spécifique ou calculer la quantité de ces réactifs nécessaires pour obtenir la quantité attendue de produits.
Ils sont largement connus dans le domaine chimique de la science "les quatre lois": loi de la conservation de la masse, loi des proportions définies, loi de proportions multiples et droit des proportions réciproques.
Les 4 lois stoichiométriques
Lorsque l'on souhaite déterminer la façon dont deux éléments sont combinés par une réaction chimique, les quatre lois décrites ci-dessous doivent être prises en compte.
Droit de la conservation de masse (ou «loi de conservation de la matière»)
Cette loi est basée sur le principe que la matière ne peut être créée ou détruite, c'est-à-dire qu'elle ne peut être transformée que.
Cela signifie que pour un système adiabatique (lorsqu'il n'y a pas de transfert de masse ou d'énergie de ou vers l'environnement), la quantité de matière actuelle doit constamment rester à temps.
Par exemple, dans la formation d'eau de l'oxygène et de l'hydrogène gazeux, il est observé qu'il y a la même quantité de moles de chaque élément avant et après la réaction, de sorte que la quantité totale de matière est préservée.
Peut vous servir: couche de valence2h2(g) + ou2(g) → 2h2Ou (l)
-
Exercer:
P.- Démontrer que la réaction précédente répond à la loi de conservation de la masse.
R.- Tout d'abord, il y a les masses molaires des réactifs: h2= 2 g, ou2= 32 g et h2O = 18 g.
Ensuite, la masse de chaque élément est ajoutée de chaque côté de la réaction (équilibrée), résultant: 2h2+SOIT2 = (4 + 32) g = 36 g sur le côté des réactifs et 2h2O = 36 g sur le côté des produits. Il a donc été démontré que l'équation est conforme à la loi susmentionnée.
Loi des proportions définies (ou «loi des proportions constantes»)
Il est basé sur le fait que chaque produit chimique est formé à partir de la combinaison de ses éléments constitutifs dans des relations de masse définies ou fixes, qui sont uniques pour chaque composé.
L'exemple de l'eau, dont la composition dans son état pur2 (32g) et 2 moles de h2 (4G). Si le diviseur commun maximum est appliqué, il est constaté qu'une mol de H réagit2 pour chaque 8 moles de ou2 Ou, qu'est-ce qui est la même, ils combinent par la raison 1: 8.
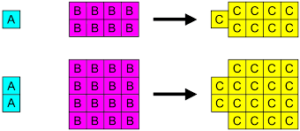
-
Exercer:
P.- Il y a une taupe d'acide chlorhydrique (HCL) et vous voulez savoir quel pourcentage de chacun de ses composants est.
R.- Il est connu que la raison de l'union de ces éléments dans cette espèce est 1: 1. Et la masse molaire du composé est d'environ 36,45 g. De la même manière, il est connu que la masse molaire de chlore est de 35,45 g et que l'hydrogène est de 1 g.
Pour calculer la composition en pourcentage de chaque élément, la masse molaire de l'élément est divisée (multipliée par sa quantité de moles dans une mole du composé) entre la masse du composé et ce résultat se multiplie par cent.
Peut vous servir: Liquéfaction: concept, gaz, sols et sismique, séminalAinsi:% h = [(1 × 1) g / 36,45 g] x 100 = 2,74%
Y% cl = [(1 × 35,45) g / 36,45 g] x 100 = 97,26%
À partir de cela, il est déduit que, peu importe d'où vient le HCl, à son état pur, il sera toujours formé par 2,74% d'hydrogène et 97,26% de chlore.
Loi des proportions multiples
Selon cette loi, s'il existe une combinaison entre deux éléments pour générer plus d'un composé, la masse de l'un des éléments rejoint une masse invariable de l'autre, conservant une relation qui se manifeste par de petits nombres.
Le dioxyde et le monoxyde de carbone sont donnés comme exemple, qui sont deux substances constituées par les mêmes éléments, mais dans le dioxyde, elles sont liées comme O / C = 2: 1 (pour chaque atome de C, il y a deux de O) et dans le Monoxyde sa relation est 1: 1.
-
Exercer:
P.- Vous avez les cinq oxydes différents qui peuvent être stables stables combinant l'oxygène et l'azote (n2Ou non, n2SOIT3, N2SOIT4 et n2SOIT5).
R.- Il est observé que l'oxygène dans chaque composé augmente, et qu'avec une proportion fixe d'azote (28 g), il y a un rapport de 16, 32 (16 × 2), 48 (16 × 3), 64 (16 × 4) et 80 (16 × 5) g d'oxygène respectivement; c'est-à-dire qu'il y a une raison simple de 1, 2, 3, 4 et 5 parties.
Loi des proportions réciproques (ou "Loi des proportions équivalentes")
Il est basé sur la relation entre les proportions dans lesquelles un élément est combiné dans différents composés avec différents éléments.
En d'autres termes, si une espèce A rejoint une espèce B, mais elle est également combinée avec C; Il faut que les éléments B et C soient joints, la relation de masse de celles-ci correspond à les masses chacune lorsqu'elles se joignent en particulier à une masse fixe de l'élément A.
-
Exercer:
P.- Si vous avez 12 g de C et 64g de S pour former CS2, De plus, il y a 12 g de C et 32 g d'o pour créer CO2 et enfin 10g de s et 10g de o pour produire ainsi2. Comment illustrer le principe des proportions équivalentes?
Il peut vous servir: acide hypocléreux (HCLO): structure, propriétés, utilisations, synthèseR.- La proportion de masses de soufre et d'oxygène en combinaison avec une pâte de carbone définie est égale à 64:32, c'est-à-dire 2: 1. Ensuite, la proportion de soufre et d'oxygène est de 10:10 lors de la rejoindre directement ou, ce qui est le même, 1: 1. Ainsi, les deux relations sont de simples multiples de chaque espèce.
Les références
- Wikipédia. (s.F.). Stoechiométrie. Récupéré de.Wikipédia.org.
- Chang, R. (2007). Chemistry, neuvième édition (McGraw-Hill).
- Jeune, s. M., Vining, W. J., Jour, r., et botch, b. (2017). (Chimie générale: les atomes d'abord. Récupéré des livres.Google.co.aller.
- Szabadváry, f. (2016). Historique de la chimie analytique: série internationale de monographies en chimie analytique. Récupéré des livres.Google.co.aller.
- Khanna, s. K., Verma, n. K., Et Kapila, b. (2006). Excel avec des questions objectives en chimie. Récupéré des livres.Google.co.aller.

