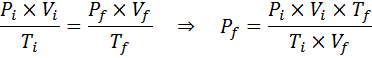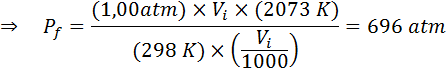Loi générale sur les gaz

- 4499
- 756
- Prof Noah Collet
Quelle est la loi générale sur le gaz?
La Loi générale sur les gaz, Parfois aussi appelé la loi combinée des gaz, c'est la combinaison des lois de Boyle, Charles et Gay-Lussac. C'est une loi qui décrit la relation entre la pression, la température et le volume d'une quantité fixe d'un gaz idéal.
L'énoncé de cette loi dit:
«Si le nombre de moles de gaz est constant, la relation entre le volume de pression et le produit de température reste constant."
Sous forme mathématique, la loi générale des gaz est exprimée comme suit:
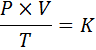
Où p représente la pression du gaz, v son volume, t sa température absolue, et k est une constante de proportionnalité, dont la valeur dépend à la fois de la quantité de gaz actuel et des unités dans lesquelles les autres variables sont exprimées.
Formes alternatives de la loi générale sur le gaz
Comme droit de proportionnalité
Un autre moyen d'énoncer la loi générale des gaz est sous la forme d'une loi de proportionnalité:
"Pour toute quantité fixe de gaz, le produit de sa pression et son volume est directement proportionnel à la température".
Cela signifie que:
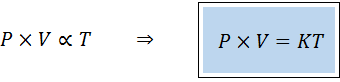
Cela équivaut à multiplier les deux membres de la première équation par température.
Relation entre l'état initial et final
Comme les lois de Boyle, Charles et Gay-Lussac, la loi générale sur le gaz peut s'exprimer comme une relation entre l'État initial et l'état final d'un gaz qui subit un changement d'État.
Contrairement aux lois précédentes, il n'est pas nécessaire qu'aucune des trois variables ne reste constante, seul le nombre de moles. C'est-à-dire que le rapport PXV / T sera le même à l'état initial, Toi, Et dans l'état final, F. En d'autres termes, la loi générale sur le gaz peut également s'exprimer mathématiquement comme suit:
Il peut vous servir: acide píchric: qu'est-ce que la structure, la synthèse, les propriétés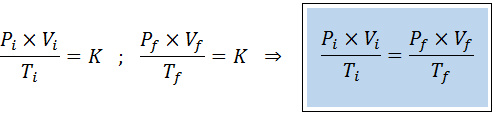
Dérivation de la formule du droit général du gaz
Comme mentionné ci-dessus, la loi générale sur le gaz vient de la combinaison de Boyle, Charles et Gay-Lussac. Ces lois sont présentées ci-dessous:
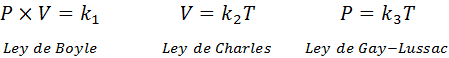
Si, à partir de chacune de ces lois, nous effacons la constante k, Et puis nous les multiplions les uns avec les autres, nous obtenons:
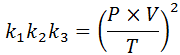
Maintenant, prenant la racine carrée des deux membres, la loi générale sur le gaz est obtenue:
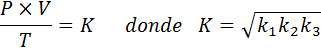
La loi générale des gaz vs. La loi des gaz idéaux
La loi générale sur les gaz avec la loi idéale sur les gaz ne doit pas être confuse. En dépit d'être deux lois très similaires et également étroitement liées, la loi générale sur le gaz ne combine que les lois de Boyle, Charles et Gay-Lussac.
Pour sa part, la loi idéale sur les gaz ajoute le principe d'Avogadro, selon lequel "Des volumes égaux de gaz différents mesurés dans les mêmes conditions de température et de pression, contiennent le même nombre de particules ».
En conséquence, en plus de relier la température, le volume et la pression, la loi du gaz idéal permet également à ces variables d'être liées au nombre de particules ou aux moles de gaz, il représente donc l'équation d'état du statut de la Gaz idéaux.
Dans les équations suivantes, la différence entre ces deux lois peut être observée plus facilement:

Notez que la principale différence entre les deux lois est que la loi de gaz idéale comprend n, qui représente le nombre de moles, et aussi au lieu de la constante K, a La constante r qui est la constante des gaz idéaux.
Peut vous servir: terpenosOn pourrait dire que la loi idéale sur les gaz est plus générale que la loi générale sur le gaz, car elle peut être appliquée pour toute quantité de gaz dans tout ensemble de pression, de température et de volume. En revanche, l'application de la loi générale sur le gaz exige que la quantité de gaz reste constante.
Exemples de l'application de la loi générale sur le gaz
Voici quelques exemples de problèmes typiques dans lesquels la loi générale sur le gaz peut être appliquée:
Exemple 1: une bulle d'air sous-marine
Supposons qu'un plongeur qui est à une profondeur de 20 m sous l'eau où la pression est de 3,00 atm et que la température est de 15 ° C libère une bouffée d'air et l'une des bulles a un volume initial de 100 cm3.
Déterminez le volume de la bulle d'air lorsqu'il atteint la surface qui est dans des conditions de température et de pression standard, en supposant que la quantité d'air à l'intérieur de la bulle ne change pas à mesure qu'elle monte.
Solution
Tout d'abord, nous devons extraire toutes les données de l'instruction. Il est entendu qu'il existe deux états différents pour le gaz, une initiale et une extrémité, nous séparons donc les données en deux groupes. Il est également nécessaire de convertir les températures à température absolue:

Comme le problème spécifie qu'il n'y a pas de changement dans la quantité de gaz (l'air), nous pouvons appliquer la loi générale sur le gaz, à partir de laquelle nous pouvons effacer le volume final:
Peut vous servir: Rodio: histoire, propriétés, structure, utilisations, risque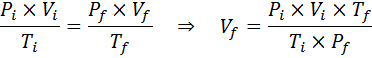
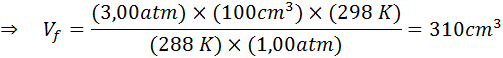
Par conséquent, la bulle d'air atteint un volume de 310 cm3 En atteignant la surface.
Exemple 2: haute pression
Quelle sera la pression d'un gaz idéal à une température ambiante de 25 ° C et une pression de 1,00 atm et comprime le millième de son volume en même temps chauffer jusqu'à 1800 ° C dans un récipient scellé?
Solution
Comme précédemment, nous commençons par extraire les données:

Comme il est dit que le processus est effectué dans un récipient scellé, la quantité de gaz ne change pas, de sorte que la loi générale sur le gaz peut être appliquée: