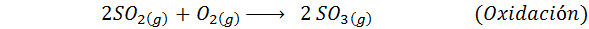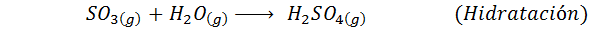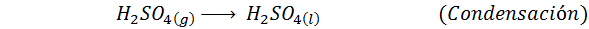Acide sulfurique (H2SO4)

- 3356
- 886
- Noa Da silva
Nous expliquons ce que l'acide sulfurique, sa structure chimique, ses propriétés, comment elle est obtenue, les applications et les risques d'utilisation
 Bateaux d'acide sulfurique (H2SO4)
Bateaux d'acide sulfurique (H2SO4) Qu'est-ce que l'acide sulfurique?
Il acide sulfurique, Également appelée huile de sulfate d'hydrogène et de vitriol, il s'agit d'un acide de soufre oxacide formé par la réaction de l'anhydride sulfurique (donc3) et de l'eau. Sa formule moléculaire est H2Swin4 Et c'est de loin l'acide minéral le plus produit et utilisé.
Il s'agit d'un acide minéral fort et hautement corrosif qui est miscible avec de l'eau afin qu'il puisse être préparé sous forme de solutions de presque toutes les concentrations entre 0 et environ 18 molaires.
Les volumes élevés de production et de consommation de ce composé sont dus à ses multiples applications dans les industries aussi variées que l'agriculture, l'industrie pétrochimique, dans la synthèse organique et inorganique et dans le traitement des eaux usées, pour n'en nommer que quelques-unes.
Structure d'acide sulfurique
L'acide sulfurique est formé par un atome de soufre central avec Valencia VI qui est entouré de 4 atomes d'oxygène, dont deux sont liés aux atomes d'hydrogène. Sa structure Lewis est présentée ci-dessous:
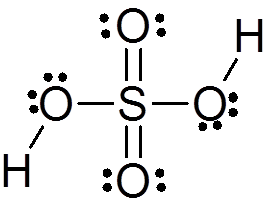
Comme vous pouvez le voir, le soufre dans ce composé est entouré de 12 électrons (6 paires), il représente donc l'une des exceptions de la règle des octets.
Étant entouré de 4 atomes, la théorie de la répulsion des paires électroniques de Valencia (Trepev) prédit que ce composé doit supposer une géométrie approximativement tétraédrique, qui est montrée dans l'image suivante:
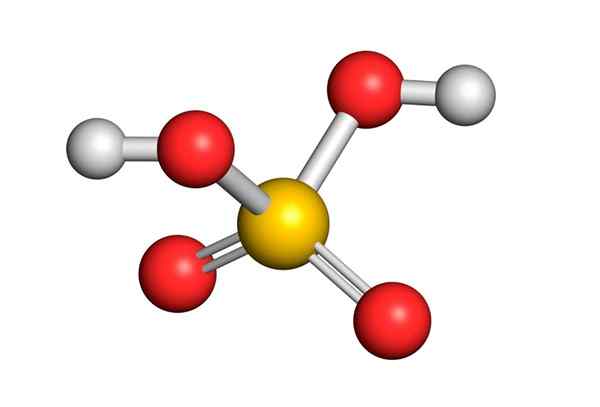
En raison de l'électronégativité élevée de l'oxygène et des différentes structures de résonance que l'acide sulfurique peut avoir, les liaisons entre l'oxygène et les hydrogènes sont fortement polarisées, ce qui les rend très acides et faciles à dissocier les hydrogènes.
Propriétés d'acide sulfurique
À la suite de sa structure, l'acide sulfurique a les propriétés physiques et chimiques suivantes:
Il peut vous servir: époxyde: nomenclature, obtention, applications, exemplesPropriétés physiques
- L'acide sulfurique pur est un liquide incolore et de toilette qui a une densité de 18302 g / ml.
- Son point de fusion est de 10,31 ° C et l'ébullition est de 337 ° C, bien qu'à cette température, elle a tendance à décomposer à produire de l'eau et de l'anhydride sulfurique (également appelé trioxyde de soufre).
- Il est complètement miscible avec l'eau, vous pouvez donc préparer des solutions avec n'importe quelle concentration. Cependant, les solutions avec plus de 98,3% de la masse de cet acide sont instables et se décomposent jusqu'à ce que sa concentration diminue à 98,3%. Cette solution est stable et est ce que l'on appelle l'acide sulfurique concentré.
- Dans son état pur ou concentré, c'est un liquide plus visqueux que l'eau.
Propriétés chimiques
- L'acide sulfurique pur est une substance fortement oxydante et corrosive. Il a la capacité d'oxyder, de déshydrater et de sulfonar à une grande variété de composés organiques et de carboniser les autres.
- Il s'agit d'un fort acide diprotique qui perd complètement son premier proton en dissolvant dans l'eau, devenant ainsi sa base conjuguée, l'ion bisulfate (HSO4-). Cet ion est également un acide, bien que plus faible que l'acide d'origine.
- Les solutions aqueuses d'acide sulfurique sont fortement acides et sont capables de dissoudre de nombreux métaux, générant de l'hydrogène gazeux. Ils sont également capables de neutraliser complètement les bases fortes.
- Réagit violemment avec de nombreux alcools et eau, libérant de grandes quantités de chaleur dans le processus.
Comment l'acide sulfurique est-il obtenu?
Les trois processus de production d'acide sulfurique les plus connus sont les suivants: le processus de contact, le processus d'acide sulfurique humide et le processus de caméras au plomb.
1. Synthèse d'acide sulfurique par le processus de contact
C'est la méthode la plus utilisée aujourd'hui pour produire de l'acide sulfurique. Le processus se compose de 5 étapes dans lesquelles le soufre élémentaire devient du dioxyde de soufre (donc2), puis le trioxyde de soufre (donc3), acide disulfurique (h2S2SOIT7) et, enfin, dans l'acide sulfurique. Les réactions impliquées sont:
Peut vous servir: quel est le losange de sécurité et à quoi sert?
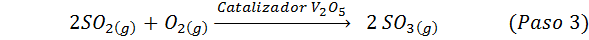


La deuxième étape du processus se compose simplement de la purification du dioxyde de soufre avant d'être convertie en trioxyde de soufre ou d'anhydride sulfurique. La réaction de la troisième étape se produit lorsque le dioxyde de soufre gazeux entre en contact avec un catalyseur de pentaoxyde de vanaoxyde solide (V2SOIT5), Et c'est pourquoi la méthode est appelée le processus de contact.
2. Synthèse d'acide sulfurique par le processus humide
Ce processus a été conçu pour purifier les gaz d'émission d'une grande variété d'industries chimiques et de plantes. Le sous-produit de cette purification est l'acide sulfurique de qualité commerciale en plus de la vapeur d'eau chaude, qui peut être réutilisée dans le processus industriel d'origine.
Dans le cas du processus humide, les réactions sont principalement. Les réactions importantes qui se produisent à chaque étape sont:
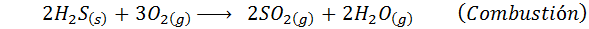
3. Synthèse d'acide sulfurique par le processus des caméras de plomb
Il s'agit d'une méthode ancienne pour produire de l'acide sulfurique qui est utilisé aujourd'hui très peu. Le processus a été de brûler le soufre élémentaire en présence d'oxygène d'air dans des chambres en bois coupées au plomb, et donc son nom.
Après cette combustion, le dioxyde de soufre réagit ensuite avec les oxydes d'azote produits par la décomposition du nitrate de sodium ou par d'autres moyens. En fin de compte, après une série de réactions supplémentaires, l'acide sulfurique a été obtenu.
Peut vous servir: Fond de fond platApplications communes
- L'application principale de l'acide sulfurique est une source de soufre sous forme de sulfates dans la fabrication d'engrais. En fait, environ 60% d'acide sulfurique produit dans le monde est destiné à cette fin.
- Dans l'industrie chimique, il est utilisé pour la synthèse des détergents, des pigments, des catalyseurs de l'industrie pétrochimique et dans le traitement des minéraux pour obtenir différents métaux.
- Enfin, l'acide sulfurique est l'électrolyte utilisé dans les batteries de plomb utilisées dans la plupart des voitures.
Risques associés à l'acide sulfurique
En raison de ses propriétés chimiques, l'acide sulfurique peut être très dangereux pour les êtres humains et les animaux et l'environnement en général. Ce sont quelques-uns des risques associés à ce produit chimique:
- Ses caractéristiques corrosives et déshydratantes font que l'acide pur provoque de grands dommages s'il entre en contact avec la peau.
- En revanche, la réaction des solutions aqueuses d'acide sulfurique avec des métaux génère de l'hydrogène gazeux, qui est un carburant et une substance explosive.
- L'acide sulfurique lui-même ne subit pas de réaction de combustion, mais, étant un fort oxydant, stimule la combustion d'autres substances, agissant comme une sorte de catalyseur, il représente donc un risque de feu considérable.
- De plus, lorsqu'il est exposé au feu, il peut être décomposé en gaz toxiques et générer des vapeurs d'acide sulfurique qui peuvent facilement détruire les voies respiratoires.
Pour ces raisons et plus encore, l'acide sulfurique est une substance qui devrait être gérée avec soin.