Caractéristiques de laminina, structure, fonctions, types
- 2525
- 633
- Louna Baron
La Laminine C'est l'une des protéines qui constitue la matrice extracellulaire de la membrane basale des tissus épithéliaux chez les animaux vertébrés. Ce type de protéine fournit un support de liaison entre les cellules tissulaires conjonctives, de sorte qu'elles fonctionnent dans la cohésion et le compactage de ces.
Généralement, les laminines sont responsables de l'ordre du réseau protéique complexe qui forme la matrice extracellulaire ou la membrane tissulaire basale. En règle générale, les laminines sont associées à des protéines telles que le collagène, les protéoglycanes, les entactines et l'hépar de sulfate.
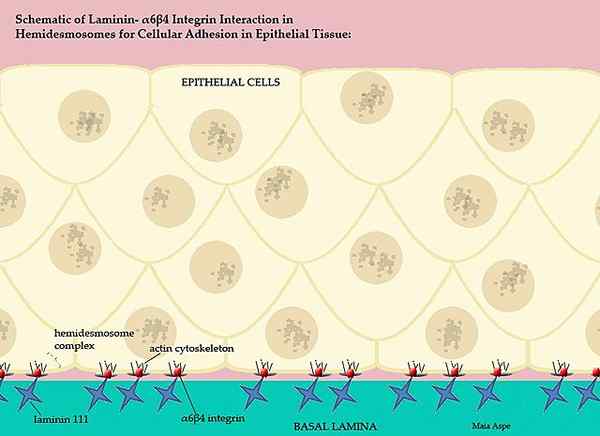
 Les laminines et leur participation à la membrane vertébrée basale (Source: MaiaAppe / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons)
Les laminines et leur participation à la membrane vertébrée basale (Source: MaiaAppe / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons) Cette membrane basale complexe, ordonnée par les laminines, sépare les parties épithéliales des tissus, c'est-à-dire que chaque matrice extracellulaire sépare l'endothélium de la mésototio et la matrice extracellulaire du mésotelito sépare cette couche de l'épithélium.
De nombreuses investigations ont montré que l'expression des gènes de laminines mutées est potentiellement mortelle pour une cellule, car celles-ci sont également responsables de la régulation de presque toutes les interactions complexes qui se produisent dans la membrane basale.
Il y a une grande diversité de familles de laminins dans tous les vertébrés. Ceux-ci varient en composition, forme, fonction et origine. Chez le même individu, dans différents tissus, différentes laminines peuvent être trouvées, chacune adaptée à l'environnement du tissu qui l'exprime.
[TOC]
Caractéristiques de laminina
Les monomères ou unités laminine sont composés d'un hétérotromer de chaînes de glycoprotéine différent. Ces protéines contiennent de nombreux domaines différents (multidominiums) et constituent une partie essentielle du développement embryonnaire précoce des tissus.
La forme commune des laminines est une sorte de "croix" ou "y", bien que certains aient une longue forme de barre avec quatre ramifications. Cette petite variation permet à chaque type de laminine régulière l'intégration adéquate de toute position dans le tissu.
Il peut vous servir: P-nitrofénol: caractéristiques, utilisations et toxicitéLes laminins ont un poids moléculaire élevé, qui peut varier en fonction du type de laminine, de 140 à 1000 kDa.
En général, chaque membrane basale a un ou plusieurs types différents de laminines à l'intérieur et certains scientifiques proposent que les laminines déterminent une grande partie de la fonction physiologique des membranes basales du tissu où on trouve.
Chez les animaux vertébrés, au moins 15 types différents de laminines ont été trouvés, classés dans une famille, car ils sont formés à partir de la même coupe. Chez les animaux invertébrés, ils ont trouvé entre 1 et 2 trimères différents.
Des études actuelles suggèrent que les laminines de tous les animaux vertébrés sont survenus par la différenciation des orthologues, c'est-à-dire que tous les gènes qui codent pour les laminines ont une origine commune des animaux invertébrés.
Structure
Malgré le grand nombre de fonctions qui régulent les laminines, elles ont une structure assez simple qui, pour la plupart, est conservée parmi les différents types connus.
Chaque laminine se compose de trois chaînes différentes entrelacées les unes avec les autres formant une sorte de "fibre entrelacée". Chacune des trois chaînes est identifiée comme alfa (α), bêta (β) et gamma (γ).
La formation du trimère de chaque laminine dépend de l'union de la région C-terminale de chacune de ses chaînes. À l'intérieur de chaque molécule, ces chaînes sont appariées à travers des liaisons peptidiques et trois ponts disulfure qui donnent à la structure une grande résistance mécanique.
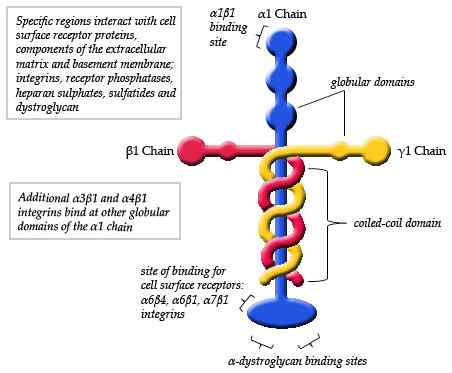 Diagramme schématique de la structure d'une laminine (source: Maiaaspe / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons)
Diagramme schématique de la structure d'une laminine (source: Maiaaspe / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons) Les observations faites par microscopie électronique des monomères de laminine typiques ont détaillé que la structure est une sorte de croix asymétrique qui a un long bras d'environ 77 nm (nanomètres) qui se caractérise par une forme globulaire proéminente à l'un de ses extrémités.
Peut vous servir: dynamique de la populationDe plus, trois bras courts sont observés, deux d'environ 34 nm et l'un d'environ 48 nm. Chaque bras se termine à une extrémité globulaire, similaire à la chaîne principale, mais en taille plus petite.
La différence entre les différents types de laminines est principalement due aux différences dans les chaînes α, qui peuvent être pliées de au moins trois manières différentes; Bien que les variations actuellement pour toutes les chaînes aient été identifiées:
- 5 variations ou chaînes différentes de laminine α
- 3 variations des chaînes β
- 3 variations pour les chaînes γ
Les fonctions
La fonction la plus importante et couramment étudiée des laminines est celle de l'interaction avec les récepteurs qui sont ancrés dans les membranes cellulaires des cellules adjacentes aux membranes basales où elles sont trouvées.
Cette interaction rend ces protéines impliquées dans la régulation de plusieurs activités cellulaires et voies de signalisation. Il est dû à mentionner que leurs fonctions dépendent de leur interaction avec des récepteurs spécifiques à la surface des cellules (de nombreux récepteurs de la membrane sont actuellement classés en fonction de leur capacité à se syndiquer aux lamins).
Les intégrines sont les récepteurs qui interagissent avec les laminines et les récepteurs "non intégrin" sont ceux qui n'ont pas la capacité de rejoindre ces protéines. La plupart des récepteurs «non intégrin» sont des protéoglycanes, certains dystroglycanes ou syndecanos.
La maturation des tissus des organes du corps a lieu avec un remplacement des premières laminines, qui étaient initialement logées dans la membrane basale des tissus qui formaient les organes jeunes.
Dans les laminines, le type qui a été étudié le plus est la laminine-1, qui est directement lié à la croissance des axones de pratiquement tous les types de neurones dans des conditions In vitro, Puisqu'ils régulent le mouvement du "cône de croissance" à la surface des neurones.
Peut vous servir: bouillon d'urée: qu'est-ce que la fondation, la préparation, les utilisationsNomenclature et types
Les biochimistes considèrent la famille des laminines comme une très grande famille de protéines, dont peu de membres sont encore connus. Cependant, les outils modernes permettront à de nouveaux types de laminines d'être entrevues.
Ces protéines sont identifiées chacune avec un nombre, en commençant par 1 terminant la numérotation en 15 (laminine-1, laminine-2 ... laminina-15).
Un autre type de nomenclature est également utilisé, ce qui indique le type de chaîne que chaque laminine a. Par exemple, la laminine-11 est composée d'une chaîne alfa (α) -5, par une chaîne bêta (β) -2 et par une chaîne gamma (γ) -1, donc elle peut être nommée laminina-521.
De plus, chaque laminine est classée en fonction de la fonction associée à laquelle il est associé et également en fonction du tissu corporel spécifique dans lequel il participe. Quelques exemples de laminines sont:
- Lamina-1: qui participe au développement épithélial
- Laminina-2: impliqué dans le développement myogénique de tous les tissus, le système nerveux périphérique et la matrice de glomérule.
- Lamina-3: Participez à des syndicats de maîtrise
- Lamina-4: fonctionne dans les unions neuromusculaires et dans la matrice mésangiale des glomérules
- Laminina-5, 6 et 7: ils agissent de préférence dans les tissus épidermiques.
Les références
- Mineur, J. H., & YurChenco, P. D. (2004). Fonctionne la laminine dans la morphogenèse tissulaire. Anneau. Tour. Cellule de développement. Biol., 20, 255-284.
- Rasmussen, D. g. K., & Karsdal, m. POUR. (2016). Laminines. En biochimie des collagènes, des laminines et de l'élastine (PP. 163-196). Presse universitaire.
- Sasaki, t., Fässler, r., & Hohenester, et. (2004). Laminine: le nœud de l'assemblage de la membrane du sous-sol. The Journal of Cell Biology, 164 (7), 959-963.
- TIMPL, R., Engel, J., & Martin, G. R. (1983). Laminine multifonctionnelle de la protéine des membranes basales. Tendances des sciences biochimiques, 8 (6), 207-209.
- TIMPL, R., Rohde, H., Robey, P. g., Rennard, s. Toi., Foidart, J. M., & Martin, G. R. (1979). Laminine-une glycoprotéine des membranes du sous-sol. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). La famille laminine. Opinion actuelle en biologie cellulaire, 5 (5), 877-882.

