Joseph Thomson

- 2104
- 576
- Paul Dumas
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) C'était un chimiste britannique High. Il a remporté le prix Nobel de physique en 1906.
Il est né à Cheetam Hill, un district de Manchester, en Angleterre, le 18 décembre 1856. Également connu sous le nom de "J.J."Thomson a étudié l'ingénierie à Owens College, qui fait actuellement partie de l'Université de Manchester, puis des mathématiques à Cambridge.
En 1890, J.J. Thomson a épousé Rose Elizabeth Paget, fille du docteur Sir Edward George Paget, avec qui elle a eu deux enfants: une fille, nommée Joan Paget Thomson, et un enfant, George Paget Thomson.
Ce dernier deviendrait un scientifique célèbre, obtenant en 1937 un prix Nobel en physique pour leur travail avec des électrons.
Dès son jeune âge, Thomson a concentré ses études sur la structure des atomes, découvrant ainsi l'existence d'électrons et d'isotopes, entre autres.
En 1906, Thomson a reçu le prix Nobel en physique, "en reconnaissance du grand mérite de ses recherches théoriques et expérimentales sur la conduction de l'électricité par le biais de gaz", comme le fait le jury dans le verdict du prix susmentionné.
En 1908, il a été nommé chevalier par la Couronne britannique et a été professeur honoraire de physique à Cambridge et au Royal Institute, Londres.
Il est décédé le 30 août 1940 à 83 ans, dans la ville de Cambridge, en Angleterre. Le physicien a été enterré dans l'abbaye de Westminster, près du tombeau de Sir Isaac Newton.
Contributions de Joseph Thomson à la science et à la chimie
Découverte d'électrons
En 1897, J.J. Thomson a découvert une nouvelle particule légère que l'hydrogène, qui a été baptisée "électron".
Il peut vous servir: détermination des cendres: méthodes et exemplesL'hydrogène était considéré comme une unité de mesure du poids atomique. Jusque-là, l'atome était la plus petite division de la matière.
En ce sens, Thomson a été le premier à découvrir les particules subatomiques corpusculaires chargées négativement.
Modèle atomique Thomson
Le modèle atomique de Thomson était la structure que le physicien anglais a attribué aux atomes. Pour le scientifique, les atomes étaient une sphère de charge positive.
Il y avait uniformément les électrons distribués négativement sur ce nuage de charge positif, c'est-à-dire, neutralisant la charge positive de la pâte à atome.
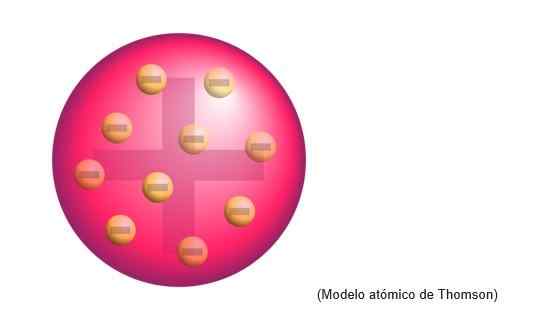
Ce nouveau modèle remplace l'élaboration par Dalton et sera ensuite réfuté par Rutherford, le disciple de Thomson dans les Cavendish Laboratories de Cambridge.
Séparation des atomes
Thomson a utilisé des rayons positifs ou anodiques pour séparer les atomes de la masse différente. Cette méthode lui a permis de calculer l'électricité transportée par chaque atome et le nombre de molécules par centimètre cube.
Pouvant diviser les atomes de masse et de charge différentes, le physicien a découvert l'existence d'isotopes. Également de cette manière, avec son étude des rayons positifs, il a produit une grande avancée vers la spectrométrie de masse.
Découverte des isotopes
J.J. Thomson a découvert que les ions néon avaient des masses différentes, c'est-à-dire un poids atomique différent. C'est ainsi que Thomson a montré que le néon a deux sous-types d'isotopes, le néon-20 et le néon-22.
Les isotopes, étudiés jusqu'à aujourd'hui, sont des atomes du même élément, mais leurs noyaux ont un nombre de masse différent, car ils sont composés de différentes quantités de neutrons dans leur centre.
Expériences avec des rayons de cathode
Les rayons cathodiques sont des courants électron.
Peut vous servir: hydroxyde de chrome: structure, propriétés, synthèse, utilisationsLorsque l'électrode négative est chauffée, également appelée cathode, il émet un rayonnement qui est dirigé vers l'électrode positive ou l'anode, en ligne droite si aucun champ magnétique ne se produit dans cette route.
Si les parois en verre du tube sont recouvertes de matériau fluorescent, le coup des cathodes contre cette couche produit la projection de la lumière.
Thomson a étudié le comportement des rayons de cathode et est arrivé aux conclusions que les rayons se sont propagés droit.
Il a également conclu que ces rayons pouvaient être détournés de leur trajectoire par la présence d'un aimant, c'est-à-dire d'un champ magnétique. De plus, les rayons pouvaient déplacer les lames avec la résistance des électrons qui circulent, démontrant ainsi que les électrons avaient une masse.
J.J. Thomson a connu le gaz à l'intérieur du tube à rayons cathodiques, mais le comportement des électrons ne variait pas. De même, les rayons de cathode réchauffaient les objets qui interposaient sur la route entre les électrodes.
En conclusion, Thomson avait montré que les rayons de cathode avaient des effets légers, mécaniques, chimiques et thermiques.
Les tubes des rayons cathodiques et leurs propriétés lumineuses étaient transcendantales pour l'invention ultérieure de la télévision par tube (CTR) et des caméras vidéo.
Spectromètre de masse
J.J. Thomson a créé une première approche pour Spectromètre de masse. Cet outil a permis à l'étude des scientifiques.
Avec cette enquête, il a conclu que les rayons de cathode étaient composés de corpuscules de charge négative, qui se trouvent à l'intérieur des atomes, postulant ainsi la divisibilité de l'atome et donnant naissance à la figure électronique.
Il peut vous servir: acide butyrique: formule, propriétés, risques et utilisationsDe plus, les progrès de la spectrométrie de masse se sont poursuivis jusqu'à aujourd'hui, évoluant dans différentes méthodes pour séparer les électrons des atomes.
De plus, Thomson a été le premier à suggérer Le premier guide de vague en 1893. Cette expérience était constituée de propagation.
Les guides d'ondes seraient largement utilisés à l'avenir, même aujourd'hui, avec la transmission des données et la fibre optique.
L'héritage de Thomson
Le Thomson (TH) a été établi comme une unité de charge de masse en spectrométrie de masse, proposée par Cooks and Rockwood Chemicals, en l'honneur de Thomson.
Cette technique permet de déterminer la distribution des molécules d'une substance en fonction de leur masse et, reconnaissant par ceci, qui sont présentes dans un échantillon de matière.
Formule Thomson (TH):
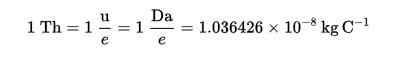
Œuvres exceptionnelles
- La discrétion de l'électricité à travers les gaz, l'électricité à travers les gaz (1900).
- La théorie corpusculaire de la matière, l'électron dans la chimie et les souvenirs et les réflexions (1907).
- Au-delà de l'électron (1928).
Les références
- Nobel Media AB (2014). J. Thomson - biographique. Prix Nobel.org. Prix Nobel.org.
- Thomson, Joseph J., Électricité à travers le comportement des gaz. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Le charme discret des particules élémentaires.
- Christen, Hans Rudolf, Fondamentaux de la chimie générale et inorganique, volume 1. Barcelone Espagne. Éditions REVERTÉ S.POUR., 1986.
- Arzani, Aurora Cortina, Chimie générale élémentaire. Mexique, éditorial de Porrúa, 1967.
- R. g. Cuisiniers, un. L. Rockwood. Commun rapide. Spectre de masse. 5, 93 (1991).

