Isóbaros
- 2674
- 281
- Mlle Ambre Dumont
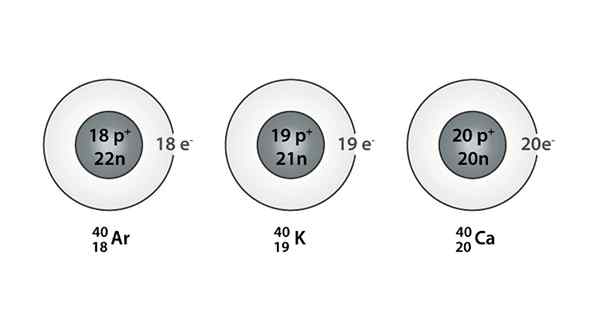
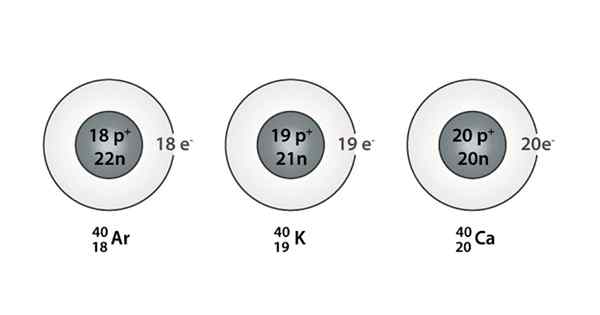 Exemple d'Isóbaro; Argon, potassium et calcium, qui ont des atomes de la même masse (40)
Exemple d'Isóbaro; Argon, potassium et calcium, qui ont des atomes de la même masse (40) Quels sont les isoparos?
Les Isóbaros Ce sont ces espèces atomiques qui ont la même masse mais qui proviennent de différents éléments chimiques. En conséquence, on peut dire qu'ils sont constitués par différents nombres de protons et de neutrons.
Les protons et les neutrons sont dans le noyau de leurs atomes, mais la quantité nette de neutrons et de protons présents dans chaque noyau reste le même. En d'autres termes, une espèce Isóbara provient lorsqu'une paire de noyaux atomiques montre le même nombre net de neutrons et de protons pour chaque espèce.
Cependant, le nombre de neutrons et de protons qui constituent que le montant net est différent. Une façon de le remarquer est d'observer le nombre de masse (qui est placé sur le côté supérieur gauche du symbole de l'élément chimique qui est représenté), car dans les isopies, ce nombre est le même est le même est le même.
L'étymologie du terme Isóbaro vient de mots grecs ISOS (ce qui signifie "le même") et Baros (ce qui signifie «poids»), qui fait référence à l'égalité des poids entre les deux espèces nucléaires.
Caractéristiques des isoparos
- Les Isoparos gardent certaines similitudes avec d'autres espèces dont les noyaux présentent des coïncidences, telles que les isotones, qui ont la même quantité de neutrons mais avec un nombre de nombres masse et atomique différents, comme les pairs 13C et 14Non 36Sable 37CL.
- Le terme "nucléide" est la dénomination qui a été inventée à chacun des ensembles de nucléa (structures formées par des neutrons et des protons) qui peuvent être formées. De sorte que les nucléides se distinguent peut-être par leur nombre de neutrons ou de protons, ou même pour la quantité d'énergie que possède la structure de sa conglomération.
Peut vous servir: Liquéfaction: concept, gaz, sols et sismique, séminal- De même, il y a un noyau enfant survient après le β et ce processus, à son tour, c'est un isopar du noyau père, car le nombre de nucléons présents dans le noyau reste inchangé, contrairement à ce qui se passe par la désintégration α.
- Il est important de se rappeler que les différents Isóbaros ont un nombre atomique différent, confirmant qu'il s'agit d'éléments chimiques différents.
Représentation
Pour désigner les différents nucléides, une notation spécifique est utilisée, qui peut être représentée de deux manières: on consiste à placer le nom de l'élément chimique suivi de leur numéro de masse, qui sont unis par un script. Par exemple: azote-14, dont le noyau se compose de sept neutrons et sept protons.
L'autre façon de représenter ces espèces est de placer le symbole de l'élément chimique, précédé d'une superstitice numérique qui indique le nombre de masse que l'atome en question possède, ainsi qu'un indice numérique qui désigne son nombre atomique, de la manière suivante :
ZPOURX
Dans cette expression x, il représente l'élément chimique de l'atome en question, a est le nombre de masse (résultat de l'addition entre la quantité de neutrons et de protons) et Z représente le nombre atomique (égal à la quantité de protons dans le noyau de l'atome).
Lorsque ces nucléides sont représentés, le nombre atomique de l'atome (z) est généralement omis car il n'accorde pas de données supplémentaires pertinentes, il est donc souvent représenté comme POURX.
Une façon de montrer cette notation est de prendre l'exemple précédent (azote-14), qui est également désigné comme 14N. C'est la notation utilisée pour les isoboos.
Peut vous servir: propriétés étendues de la matièreExemples d'Isóbaros
L'utilisation de l'expression "isóbaros" pour les espèces appelées nucléides qui ont le même nombre de nucléons (nombre de masse égal) a été proposée à la fin des années 1910 par le chimiste de l'origine britannique Alfred Walter Stewart.
Dans cet ordre d'idées, un exemple d'isoboos peut être observé dans le cas des espèces 14C et 14N: Le nombre de masse est égal à 14, cela implique que le nombre de protons et de neutrons dans les deux espèces est différent.
En effet, cet atome de carbone a un nombre atomique égal à 6, donc dans sa structure il y a 6 protons, et à son tour il a 8 neutrons dans son noyau. Alors votre numéro de masse est de 14 (6 + 8 = 14).
Pour sa part, l'atome d'azote a un nombre atomique égal à 7, il est donc composé de 7 protons, mais il a 7 neutrons dans son noyau. Votre numéro de masse est également 14 (7 + 7 = 14).
Vous pouvez également trouver une série dans laquelle tous les atomes ont un nombre de masse égal à 40; C'est le cas des Isóbaros: 40CA, 40K, 40Ardente, 40Cl, et 40S.
Différences entre l'isoto et les isotopes
Les nucléides décrivent les différents types de noyaux atomiques qui existent, selon la quantité de protons et de neutrons qu'ils possèdent.
De même, entre ces types de nucléides se trouvent les isotropes et les isotopes, qui seront différenciés ci-dessous.
Dans le cas des Isóbaros, comme mentionné précédemment, ils ont le même nombre de nucléons - c'est-à-dire le même nombre de masse - où le nombre de protons par lesquels une espèce est plus élevée que l'autre est d'accord avec le nombre de neutrons qui sont dans déficit, donc le total est le même. Cependant, votre numéro atomique est différent.
Il peut vous servir: Solutions cristalloïdes: composition, types et exemplesEn ce sens, les espèces isopiques proviennent de différents éléments chimiques, ils sont donc situés dans différents espaces du tableau périodique et ont des caractéristiques différentes et des propriétés spécifiques.
D'un autre côté, dans le cas des isotopes, le contraire se produit, car ils ont le même nombre atomique mais une masse différente de masse; c'est-à-dire qu'ils ont le même nombre de protons mais un nombre différent de neutrons à l'intérieur de leurs noyaux atomiques.
De plus, les isotopes sont des espèces atomiques appartenant aux mêmes éléments, ils sont donc situés dans le même espace dans le tableau périodique et ont des caractéristiques et des propriétés similaires.

