Ionisation dans le concept, les processus et les exemples de la physique et de la chimie

- 5044
- 655
- Noa Da silva
La ionisation C'est tout ce processus dans lequel les charges électriques sont générées à partir de particules neutres. Cela peut avoir lieu à travers divers mécanismes naturels ou forces, soit par rayonnement, chaleur, champs électriques, champs magnétiques ou réactions chimiques. Les ions sont produits en conséquence, qui sont des atomes chargés positivement ou négativement.
L'ionisation est un processus fondamental pour les symphines de phénomènes physiques, chimiques ou naturels, ce dernier étant à plusieurs reprises un mélange de changements physicochimiques. Par exemple, dans les ionisations physiques, en principe, les réactions chimiques ne se produisent pas; C'est-à-dire que la production d'ions n'implique pas la rupture ou la formation de nouveaux liens.
 De nombreux phénomènes naturels, comme les aurores boréales, sont basés sur l'ionisation des molécules de l'atmosphère. Source: Pixabay.
De nombreux phénomènes naturels, comme les aurores boréales, sont basés sur l'ionisation des molécules de l'atmosphère. Source: Pixabay. Cependant, dans les phénomènes naturels, cette ionisation s'accompagne généralement de réactions chimiques, telles que la formation d'ozone à faible altitude. De plus, pendant les orages, les oxydes d'azote sont générés en raison des rayons et de leurs températures intenses, qui oxydent l'azote de l'air.
D'un autre côté, l'ionisation peut se faufiler: dans la même eau, dans le frottement entre deux surfaces, dans les oxydations des métaux ou dans la dissolution de certains gaz dans l'eau.
[TOC]
Ionisation de chimie
Oxydation-réduction
 Pendant le fonctionnement des batteries d'un jouet, les ions et les électrons sont continuellement. Source: D J shin / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Pendant le fonctionnement des batteries d'un jouet, les ions et les électrons sont continuellement. Source: D J shin / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) Dans l'ionisation chimique, les ions sont produits par une formation de rupture ou de liaison. Deux substances gagnent ou perdent de manière irréversible les électrons: celui qui perd les électrons acquiert une charge positive, tandis que celui qui gagne conserve une charge négative.
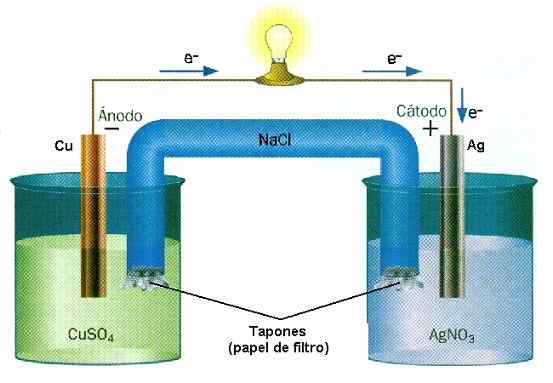
 Exemple de réduction de la réaction d'oxyde dans la pile Cu-Ag. Source: mur d'eau / cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)
Exemple de réduction de la réaction d'oxyde dans la pile Cu-Ag. Source: mur d'eau / cc by-sa (http: // CreativeCommons.Org / licences / by-sa / 3.0 /) Dans les batteries, une substance perd des électrons tandis qu'un autre les gagne. Ces électrons voyagent et activent les circuits électriques d'un équipement, pour enfin revenir à un deuxième compartiment de pile, où l'autre substance les attend pour les attraper et se charger négativement. Ceci est un exemple d'une ionisation chimique réalisée par une réaction de réduction de l'oxyde.
Peut vous servir: acide gluconique: structure, propriétés, synthèse, utilisationsRupture hétérolytique
Un autre type d'ionisation chimique est dû à la rupture hétérolithique. Lorsque cette rupture se produit, le lien A-B est cassé pour former les ions pour+ et B-, Parce que les électrons sont dirigés vers l'atome pour lequel ils "ressentent" une plus grande affinité. La rupture hétérolithique est généralement la première étape qui régit les mécanismes de nombreuses réactions organiques.
Auto-nionisation
Les charges électriques peuvent non seulement apparaître par le mouvement des électrons en soi, mais par les liens qui sont cassés ou formés dans un échange d'atomes. C'est le cas de l'auto-iisation, qui se produit entre deux molécules du même composé.
De toutes les ionisations chimiques, l'auto-iisation est la plus simple et la plus imperceptible, car elle n'a pas la capacité de mener un courant électrique par lui-même.
Ionisation en physique
Électricité statique
 Les cheveux de cette fille se charge positivement et se repoussent en raison de l'électricité statique. Source: Biseup ganguly / cc by (https: // CreativeCommons.Org / licences / par / 3.0)
Les cheveux de cette fille se charge positivement et se repoussent en raison de l'électricité statique. Source: Biseup ganguly / cc by (https: // CreativeCommons.Org / licences / par / 3.0) L'ionisation a également beaucoup de participation à des phénomènes physiques. En général, l'ionisation physique n'implique pas de réactions chimiques. Les atomes de la matière sont chargés électriquement sans perdre leur identité d'origine.
Les surfaces peuvent échanger des électrons lorsqu'ils se frottent si l'un d'eux est plus efficace pour les stocker, ce qui conduit à l'électricité statique. On ne parle plus d'atomes, mais d'un matériau entier qui acquiert une charge négative ou positive, et que lorsque l'équilibre est restauré, un choc électrique peut littéralement générer entre deux matériaux ou corps.
Ionisation gazeuse
Les atomes gazeux dispersés peuvent perdre des électrons s'ils sont soumis à un champ électrique. Ce faisant, les atomes sont excités et libérés des électrons. Ensuite, lors du refroidissement et du retour à leur statut d'énergie mineure, les photons disent au revoir. Et le processus est répété encore et encore. Le résultat: une source d'éclairage ou d'électricité.
Peut vous servir: oxyde de bore (B2O3): Qu'est-ce que la structure, les propriétés, les utilisationsRadiation ou collision ionisation
De même, la matière peut gagner de l'énergie fournie par différents types de rayonnement (gamma, rayons x, ultraviolet, etc.) ou en entrant en collision avec des particules d'énergie élevées (Alfas, Betas et Neutrons).
L'énergie contribuée est telle qu'un électron de l'atome est instantané. Ce type d'ionisation est lié à plusieurs phénomènes radioactifs et cosmiques.
Ionisation de l'eau
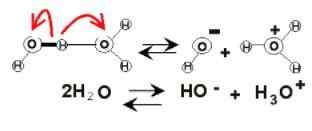 Dissociation de l'eau
Dissociation de l'eau Dans le sein de l'eau, les charges électriques peuvent apparaître en raison de son ionisation. Ceci est du produit chimique, car deux molécules d'eau réagissent soudainement les unes aux autres pour se dissocier et générer les ions H3SOIT+ et oh-:
2h2Ou (l) ⇌ h3SOIT+(Ac) + oh-(AC)
Cet équilibre a été très déplacé vers l'eau, il n'y a donc pratiquement aucune quantité méprisable de ces ions.
Ionisation de l'air
Les molécules d'air ne participent à aucun équilibre de l'auto-iisation. Oxygène, azote, argon, vapeur d'eau et les autres gaz qui composent l'air, n'échangez pas d'atomes ou d'électrons. Par conséquent, l'air n'est pas un bon conducteur d'électricité dans des conditions normales.
Cependant, s'il est soumis à un champ électrique, un rayonnement ou des températures intenses, il peut être ion et devenir un bon conducteur. C'est ce qui se passe, par exemple, lorsque les rayons électriques tombent des nuages à la terre, des électrons voyageant dans l'air avec une explosion de lumière soudaine.
Exemples d'ionisation
Tout au long des sections précédentes, certains exemples d'ionisation ont été nommés. Enfin, certains autres seront mentionnés.
Oxydation des métaux
Lorsque les métaux s'oxydent, soit par l'action de l'oxygène terre.
Peut vous servir: Processus chimique: principes, types, exemplesPar exemple, le fer est ionisé grâce à l'oxygène pour se transformer en ions foi3+, Situé dans les cristaux d'oxydes de fer. Le magnésium, en revanche, se dissout dans l'acide sulfurique pour perdre des électrons et rester en tant que mg ions2+ Dans le sel de sulfate de magnésium.
Dissolution du gaz dans l'eau
Certains gaz, comme l'ammoniac et le chlorure d'hydrogène, se dissolvent dans l'eau pour perdre leur neutralité et donner naissance à la formation d'ions. Par exemple, l'ammoniac lorsqu'il se dissout partiellement libère des ions NH4+ et oh-. Pendant ce temps, le chlorure d'hydrogène lors de la dissolution produira des ions H3SOIT+ et cl- complètement.
Un cas similaire est la dissolution des sels dans l'eau, comme le sulfate de magnésium, le MGSO4. Cependant, les ions Mg2+ Et ainsi42- Ils sont déjà présents aux cristaux de sel avant de se dissoudre dans l'eau.
Lampes ou tubes d'éclairage

Dans les lampes à vapeur ou les tubes d'éclairage, les atomes gazeux avec les chocs électriques sont ravis de produire une certaine quantité de lumière et de couleurs. Par exemple, cette ionisation se déroule dans des lampes de sodium ou de mercure, ainsi que dans les célèbres néons avec leurs couleurs vives dans les entrées de restaurant ou de magasin.
Énergies d'ionisation
L'énergie d'ionisation, une propriété périodique, est étudiée pour caractériser les éléments chimiques selon la facilité avec laquelle leurs atomes gazeux donnent leurs électrons à la charge positive. Ainsi, par exemple, les métaux ont généralement les énergies d'ionisation les plus faibles, tandis que les éléments non métalliques et les gaz nobles, le plus élevé.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- SERAY, R., Jewett, J. (2008). Physique pour la science et l'ingénierie. Volume 1. 7e. Édition. Mexique. Cengage Learning Editors.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Ionisation. Récupéré de: dans.Wikipédia.org
- Les éditeurs d'Enyclopaedia Britannica. (17 octobre 2016). Ionisation. Encyclopædia Britannica. Récupéré de: Britannica.com
- Doug Stewart. (2018). Définition de l'ionisation: qu'est-ce que l'ionisation? Récupéré de: Chemicool.com
- John Zavisa. (1er avril 2020). Comment fonctionne la foudre. Récupéré de: science.Workswork.com
- « 18 types de comportement et leurs caractéristiques (avec des exemples)
- Origine du libéralisme jaune, caractéristiques, causes, conséquences »

