Immunoglobulines
- 629
- 25
- Justine Charpentier
 Illustration des immunoglobulines
Illustration des immunoglobulines Que sont les immunoglobulines?
Le Immunoglobulines Ce sont des molécules qui fabriquent des lymphocytes B et des plasmocytes qui collaborent avec la défense de l'organisme. Ils se composent d'une biomolécule de glycoprotéine appartenant au système immunitaire. Ils sont l'une des protéines les plus abondantes du sérum sanguin, après l'albumine.
L'anticorps est un autre nom que les immunoglobulines reçoivent et sont considérés comme des globulines en raison de leur comportement dans l'électrophorèse du sérum sanguin qui les contient. La molécule d'immunoglobuline peut être simple ou complexe, selon que votre présentation est en monomère ou est polymérisée.
La structure commune des immunoglobulines est similaire à la lettre "Y". Il existe cinq types d'immunoglobulines qui ont des différences morphologiques, fonctionnelles et de localisation dans le corps. Les différences structurelles des anticorps ne sont pas en forme, mais en termes de composition; Chaque type a un objectif spécifique.
La réponse immunitaire favorisée par les immunoglobulines est très spécifique et est un mécanisme très complexe. Le stimulus de sa sécrétion par les cellules est activé en présence d'agents étranges au corps, comme une bactérie. La fonction de l'immunoglobuline sera de rejoindre l'élément étrange et de l'éliminer.
Les immunoglobulines ou anticorps peuvent être présents à la fois dans le sang et sur la surface membraneuse des organes. Ces biomolécules représentent des éléments importants au sein du système de défense du corps humain.
Structure des immunoglobulines

La structure des anticorps contient des acides aminés et des glucides, des oligosaccharides. La présence prédominante d'acides aminés, sa quantité et sa distribution sont ce qui détermine la structure de l'immunoglobuline.
Comme toute protéine, les immunoglobulines ont une structure primaire, secondaire, tertiaire et quaternaire, déterminant leur apparence typique.
En réponse au nombre d'acides aminés qu'ils présentent, les immunoglobulines ont deux types de chaîne: la chaîne lourde et la chaîne légère. De plus, selon la séquence d'acides aminés dans sa structure, chacune des chaînes a une région variable et une région constante.
Chaînes lourdes
Les chaînes lourdes d'immunoglobulines correspondent à des unités polypeptidiques composées de 440 séquences d'acides aminés.
Chaque immunoglobuline a 2 chaînes lourdes, et chacune d'elles a une région variable et une région constante. La région constante a 330 acides aminés et la variable 110 acides aminés séquencés.
La structure de la chaîne lourde est différente pour chaque immunoglobuline. Ce sont un total de 5 types de chaîne lourde qui déterminent les types d'immunoglobulines.
Les types de chaîne lourds sont identifiés avec les lettres grecques γ, μ, α, ε, Δ pour les IgG, IgM, IgA, IgE et IgD immunoglobulines, respectivement.
La région constante des chaînes lourdes ε et μ est formée par quatre domaines, tandis que ceux correspondant à α, γ, δ en ont trois. Ensuite, chaque région constante sera différente pour chaque type d'immunoglobuline, mais commune aux immunoglobulines du même type.
Peut vous servir: muscle sternocléidohioïdeLa région variable de la chaîne lourde est formée par un seul domaine d'immunoglobuline. Cette région a une séquence de 110 acides aminés et sera différente en fonction de la spécificité de l'anticorps par un antigène.
Dans la structure des chaînes lourdes, une angulation ou une flexion peut être observée - une charnière - qui représente la zone flexible de la chaîne.
Chaînes légères
Les chaînes légères des immunoglobulines sont des polypeptides constitués d'environ 220 acides aminés. Il existe deux types de chaîne légère dans l'être humain: Kappa (κ) et Lambda (λ), ce dernier avec quatre sous-types. Les domaines constants et variables ont des séquences de 110 acides aminés chacun.
Un anticorps peut avoir deux chaînes légères κ (κκ) ou une paire de chaînes λ (λλ) mais il n'est pas possible de posséder un de chaque type en même temps.
FC et segments fabuleux
Comme chaque immunoglobuline a une forme similaire à un "y" peut être divisé en deux segments. Le segment "inférieur", la base, est appelé fraction cristallissable ou FC; tandis que les bras du "y" forment le fab ou la fraction qui unit l'antigène. Chacune de ces sections structurelles d'immunoglobuline remplit une fonction différente.
Segment FC
Le segment FC a deux ou trois domaines constants des lourdes chaînes d'immunoglobuline.
Le FC peut rejoindre des protéines ou un récepteur spécifique dans les basophiles, les éosinophiles ou les cellules d'orge, il induit donc la réponse immunitaire spécifique qui éliminera l'antigène. FC correspond à l'extrémité carboxyle de l'immunoglobuline.
Segment fabuleux
La fraction ou le segment Fab d'un anticorps contient les domaines variables à ses extrémités, en plus des domaines constants des chaînes lourdes et légères.
Le domaine constant de la chaîne lourde se poursuit avec les domaines du segment FC formant la charnière. Il correspond à la fin amino-terminale de l'immunoglobuline.
L'importance du segment FAB est qu'elle permet un syndicat avec des antigènes, des substances étranges et potentiellement nocives.
Les domaines variables de chaque immunoglobuline garantissent leur spécificité par un antigène donné; Cette fonctionnalité permet même son utilisation dans le diagnostic des maladies inflammatoires et infectieuses.
Types d'immunoglobulines
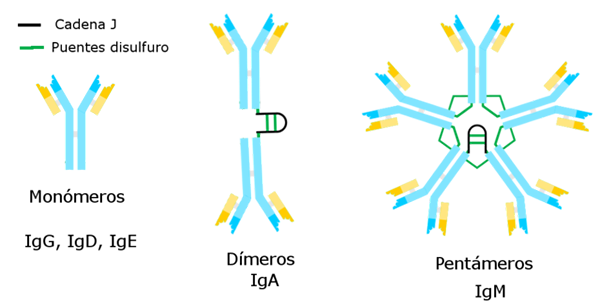 Par Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], via Wikimedia Commons
Par Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], via Wikimedia Commons Les immunoglobulines connues jusqu'à présent ont une chaîne lourde spécifique qui est constante pour chacun d'eux et la différence par rapport aux autres.
Il existe cinq variétés de chaînes lourdes qui déterminent cinq types d'immunoglobulines, dont les fonctions sont différentes.
Immunoglobuline G (IgG)
L'immunoglobuline G est la plus grande variété. Il a une chaîne gamma lourde et est présenté sous une forme unimoléculaire ou monomère.
L'IgG est la plus abondante du sérum sanguin et de l'espace tissulaire. Des changements minimaux dans la séquence d'acides aminés de sa chaîne lourde déterminent leur division en sous-types: 1, 2, 3 et 4.
Peut vous servir: sarcomroL'immunoglobuline G a une séquence de 330 acides aminés dans son segment FC et un poids moléculaire de 150 000, dont 105 000 correspondent à sa chaîne lourde.
Immunoglobuline M (IGM)
L'immunoglobuline M est un pentage dont la chaîne lourde est μ. Son poids moléculaire est élevé, environ 900 000.
La séquence d'acides aminés de sa chaîne lourde est de 440 dans sa fraction FC. Il est principalement en sérum sanguin, représentant 10 à 12% des immunoglobulines. IGM a un seul sous-type.
Immunoglobuline A (IgA)
La chaîne lourde α y correspond et représente 15% du total des immunoglobulines. L'IgA se trouve à la fois dans le sang et les sécrétions, même dans le lait maternel, se présentant sous la forme d'un monomère ou d'un dimère. Le poids moléculaire de cette immunoglobuline est de 320 000 et a deux sous-types: IgA1 et IgA2.
Immunoglobuline E (IgE)
L'immunoglobuline E est composée du type de chaîne lourde ε et est très rare dans le sérum, environ 0,002%.
IgE a un poids moléculaire de 200 000 et est présent comme monomère principalement dans le sérum, le mucus nasal et la salive. Il est également courant de trouver cette immunoglobuline dans les basophiles et les mastocytes.
Immunoglobuline D (IGD)
La variété de chaîne lourde Δ correspond à l'immunoglobuline D, qui représente 0,2% du total des immunoglobulines. Igd a un poids moléculaire de 180 000 et est structuré sous la forme d'un monomère.
Il est lié aux lymphocytes B, attachés à la surface de ces. Cependant, la fonction de l'IGD n'est pas claire.
Type Change
Les immunoglobulines peuvent subir un changement structurel de type, en raison de la nécessité de défense contre un antigène.
Ce changement est dû à la fonction des lymphocytes B des anticorps de fabrication par propriété d'immunité adaptative. Le changement structurel est dans la région constante de la chaîne lourde, sans modifier la région variable.
Un changement de classe ou de classe peut faire passer un IGM à l'IgG ou à l'IGE, et cela se produit comme une réponse induite par l'interféron gamma ou les interleucins IL-4 et IL-5.
Fonctions des immunoglobulines
Le rôle joué par les immunoglobulines dans le système immunitaire est d'une importance vitale pour la défense de l'organisme.
Les immunoglobulines font partie du système immunitaire humoral; c'est-à-dire ce sont des substances sécrétées par les cellules pour une protection contre les agents pathogènes ou les agents nocifs.
Ils fournissent un moyen de défense efficace, efficace, spécifique et systématisé, étant d'une grande valeur dans le cadre du système immunitaire. Ils ont des fonctions générales et spécifiques dans l'immunité:
Fonctions générales
Les anticorps ou les immunoglobulines remplissent à la fois des fonctions indépendantes et l'activation des réponses effectrices et sécrétoires médiées par les cellules.
Union de l'antigène-impartirpo
Les immunoglobulines ont la fonction de rejoindre des agents antigéniques spécifiquement et sélectivement.
La formation du complexe antigène-anticorps est la fonction principale d'une immunoglobuline et, par conséquent, est la réponse immunitaire qui peut arrêter l'action de l'antigène. Chaque anticorps peut rejoindre deux ou plusieurs antigènes en même temps.
Peut vous servir: os alvéolaireFonctions efficaces
La plupart du temps, le complexe antigène-anticorps sert de début à activer des réponses cellulaires spécifiques ou à démarrer une séquence d'événements qui déterminent l'élimination de l'antigène. Les deux réponses effecteurs les plus courantes sont l'union cellulaire et l'activation du complément.
L'union cellulaire dépend de la présence de récepteurs spécifiques pour le segment d'immunoglobuline FC, une fois qu'il a rejoint l'antigène.
Des cellules telles que les mastocytes, les éosinophiles, les bashocytes basophiles et les phagocytes possèdent ces récepteurs et fournissent des mécanismes d'élimination de l'antigène.
L'activation de la cascade du complément est un mécanisme complexe qui implique le début d'une séquence, donc le résultat final est la sécrétion de substances toxiques qui éliminent les antigènes.
Fonctions spécifiques
Premièrement, chaque type d'immunoglobuline développe une fonction de défense spécifique:
Immunoglobuline g
- L'immunoglobuline G fournit la plupart des défenses contre les agents antigéniques, y compris les bactéries et les virus.
- Mécanismes actifs IgG tels que le complément et la phagocytose.
- La constitution spécifique d'IgG pour un antigène est durable.
- Le seul anticorps que la mère peut transférer aux enfants pendant la grossesse est l'IgG.
Immunoglobuline m
- IgM est l'anticorps de réponse rapide avant les agents nocifs et infectieux, car il fournit une action immédiate jusqu'à ce qu'elle soit remplacée par l'IgG.
- Cet anticorps active les réponses cellulaires incorporées dans la membrane des lymphocytes et réponses humorales telles que le complément.
- C'est la première immunoglobuline qui synthétise l'être humain.
Immunoglobuline A
- Il agit comme une barrière de défense contre les agents pathogènes, lorsqu'il est situé sur les surfaces des muqueuses.
- Il est présent dans la muqueuse respiratoire, le système digestif, les voies urinaires et également dans des sécrétions telles que la salive, le mucus nasal et les larmes.
- Bien que son activation du complément soit faible, elle peut être associée à la douceur pour éliminer les bactéries.
- La présence d'immunoglobuline D à la fois dans le lait maternel et dans le Caloster permet à un nouveau-né de l'acquérir pendant l'allaitement.
Immunoglobuline e
- Immunoglobuline et fournit un solide mécanisme de défense contre les producteurs d'allergies produisant.
- L'interaction IgE et un allergène rendront les substances inflammatoires responsables des symptômes des allergies, tels que les éternuements, la toux, la ruée, l'augmentation des larmes et du mucus nasal.
- L'IgE peut également être couplée à la surface des parasites à travers son segment FC, produisant une réaction qui produit la mort de ces.
Immunoglobuline D
- La structure monomère de l'IGD est liée aux lymphocytes B qui n'ont pas interagi avec les antigènes, ils effectuent donc la fonction récepteur.
- La fonction de l'IGD n'est pas claire.

