Activation et fonctions de l'inflaménome
- 1032
- 212
- Anaïs Julien
Il flamme Il s'agit d'un complexe composé de plusieurs domaines protéiques situés dans le cytosol cellulaire, dont la fonction est d'agir comme des récepteurs et des capteurs du système immunitaire inné. Cette plate-forme est une défense Barrie.
Plusieurs études sur des souris indiquent le rôle de l'inflammasome dans l'apparition de maladies graves pour la santé publique. Par conséquent, une élaboration du médicament a été étudiée qui affecte l'inflammasoma pour améliorer les maladies inflammatoires.
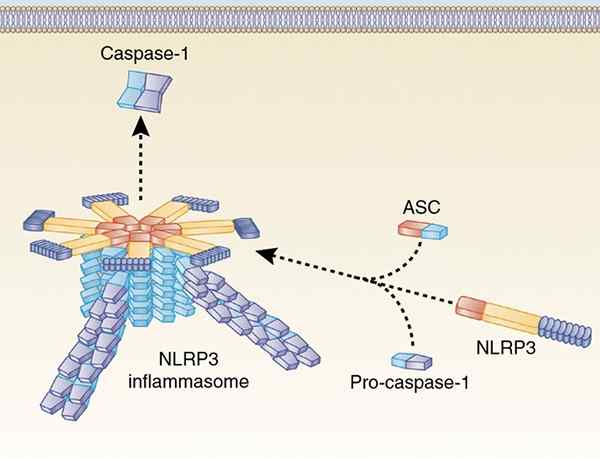 Structure des inflammasoma. Par Haitao guo [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)], de Wikimedia Commons.
Structure des inflammasoma. Par Haitao guo [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)], de Wikimedia Commons.
Les inflammommes induisent des maladies inflammatoires, auto-immunes et neurodégénératives, telles que la sclérose en plaques, la maladie d'Alzheimer et Parkinson Parkinson. Ainsi que des troubles métaboliques tels que l'athérosclérose, le diabète de type 2 et l'obésité.
Sa découverte a été faite par un ensemble de chercheurs sous la direction de DR. Tschopp (Martinon 2002). La formation de cette structure est due à l'induction de la réponse immunitaire, dont le but est l'élimination des micro-organismes pathogènes ou fonctionne comme un capteur et un activateur des processus inflammatoires cellulaires.
L'assemblage de cette plate-forme produit la stimulation de la procaspase-1 ou de la proCaspa-11, qui provoque ensuite la formation de la caspase-1 et de la caspase-11. Ces événements proviennent de la production de cytokines pro-inflammatoires de l'interleucine de type 1, appelée interleucine-1 bêta (IL-1β) et interleucin-18 (IL-18), qui proviennent de ProIL-1β et de ProIL-18.
L'inflammoms sont des structures importantes, activées par une variété de PAMP (modèles moléculaires associés à un pathogène) et DAMP (modèles moléculaires associés aux dommages). Ils induisent la coupe et la libération de l'interleucin-1 bêta (IL-1β) et de l'interleucine-18 (IL-18) cytokines pro-inflammatoires (IL-18) (IL-18) (IL-18). Ils sont formés par un récepteur avec un domaine de l'union nucléotidique (NLR) ou AIM2, ASC et Caspasa-1.
Il peut vous servir: les niveaux trophiques et les organismes qui le composent (exemples)[TOC]
Activation de l'inflammasoma
Les inflammasomes sont des soldats qui apparaissent dans le cytosol cellulaire. Ce type de réponse est dû à la présence d'agents suspects tels que les Pamps et les barrages (Lamkanfi et al, 2014). L'activation des récepteurs cytoplasmiques de la famille du domaine de l'union nucléotidique (NLR) provient du complexe.
Certains exemples sont NLRP1, NLRP3 et NLRC4, ainsi que d'autres récepteurs tels que le So-calme absent dans le mélanome 2 (AIM2). Au sein de ce groupe, l'inflammasome qui a été évalué dans une plus grande mesure est NLRP3, en raison de sa grande importance physiopathologique, dans les processus infectieux et inflammatoires. L'adaptateur ASC et la protéine effective Caspasa-1 participe également.
Naissance de nlrp3
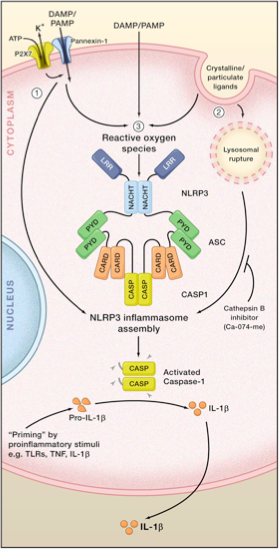
NLRP3 Flammage est né en réponse à un groupe de signaux qui peuvent être des composants bactériens, fongiques, protozoaires ou viraux. Ainsi que d'autres facteurs tels que l'adénosine triphosphate (ATP), la silice, l'acide urique, certaines toxines inductives à pores, entre autres (Halle 2008). La figure 1 montre la structure NLRP3.
NLRP3 Flammasome est activé par des signaux variés, qui ressemblent à un feu artificiel qui indique ladite structure qui commence à fonctionner. Les exemples sont la production de potassium de la cellule, la production de composants réactifs à l'oxygène des mitochondries (ROS), la libération de la cardiolipine, de l'ADN mitochondrial ou du catepsina.
Les signaux moléculaires liés aux micro-organismes pathogènes (PAMP) ou aux inductances de danger (humides) et aux cytokines pro-inflammatoires (telles que TNF-α, IL-1β, IL-6, IL-18), Wake Up NF-KB-KB. Ceci est le signal de l'activation de l'inflammasome NLRP3. Il induit la production de NLRP3, Pro-IL1β et Pro-IL-18 et des cytokines pro-inflammatoires telles que IL-6, IL-8 et TNF-α, entre autres.
Un signal ultérieur indique au NLRP3 inflammasome qu'il est assemblé de sorte que le complexe NLRP3 / ASC / Pro-Casasa-1 apparaît, qui informe le caspasa-1 qui doit être activé. L'étape postérieure induit que pro-C-1β et Pro-IL-18 mûrissent et créent IL-1β et IL-18 sous leurs formes actives.
Il peut vous servir: Timolphthalein: caractéristiques, préparation et applicationsIL-1β et IL-18 sont des cytokines qui soutiennent le processus inflammatoire. De plus, avec ces événements, l'apoptose et le pyroptosi peuvent apparaître.
 Modèles d'activation NLRP3. Par rjOO317 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], de Wikimedia Commons.
Modèles d'activation NLRP3. Par rjOO317 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], de Wikimedia Commons.
Fonctions de l'inflammasoma
L'infamosome NLRP3 est en macrophages, monocytes, cellules dendritiques et neutrophiles. Cela peut être un ange lorsqu'il attaque les agents infectieux en activant le processus inflammatoire. Ou au contraire, un démon qui peut induire l'avance de plusieurs maladies. Cela provient d'une activation désordonnée et sans contrôle lorsque sa régulation est affectée.
Inflamasoma est le principal acteur des événements de la physiologie et de la pathologie de certaines maladies. Il a été observé que cela intervient dans les affections associées à l'inflammation. Par exemple, le diabète de type 2 et l'athérosclérose (Duewell et al, 2010).
Certaines études montrent que les syndromes d'auto-inflammatoires sont dus à des problèmes dans la régulation de NLPR3, qui provoque une inflammation chronique très profonde et désordonnée, apparemment associée à la production d'IL-1β. Avec l'utilisation d'antagonistes de cette cytocine, la maladie diminue ses effets nocifs sur les individus affectés (Meinzer et Col, 2011).
Rôle des inflammasomes dans le développement des maladies
Certaines enquêtes ont montré que les inflammasomes sont importants dans les dommages produits pendant les maladies du foie. Imaeda et al. (2009) suggèrent que l'inflammasome NLRP3 agit dans l'hépatotoxicité de l'acétaminophène. Ces études observent que les souris ayant un traitement avec de l'acétaminophène et le manque de NLRP3 ont moins de mortalité.
NLRP3 Flammage fonctionne comme un régulateur intestinal de l'homéostasie en modulant la réponse immunitaire au microbiote intestinal. Chez les souris déficientes dans NLRP3, la quantité et le type de microbiote (Dupaul-Chicoine et al, 2010) change.
En conclusion, l'inflammasome peut agir du bon côté en tant que plate-forme moléculaire qui attaque les infections, ainsi que le côté obscur tel que l'activateur de Parkinson, Alzheimer, le diabète sucré de type 2 ou l'athérosclérose, pour en mentionner seulement quelques-uns.
Peut vous servir: dénaturation des protéines: ce qui est, les facteurs, les conséquencesLes références
- Strowig, t., Henao-Mejia, J., Elinav, E. & Flavell, R. (2012). Inflammmasomes en santé et en maladie. Nature 481, 278-286.
- Martinon F, Burns K, Tschopp J. (2002). L'inflammmasome: à la plate-forme moléculaire déclenchant l'activation des caspases inflammatoires et le traitement de la soi-disant PROIL. Moll Cell, 10: 417-426.
- Guo H, Callaway JB, Ting JP. (2015). Inflammasomes: mécanisme d'action, rôle dans la maladie et thérapeutique. Nat Med, 21 (7): 677-687.
- Lamkanfi, m. & Dixit, V.M. (2014). Mécanismes et fonctions des masomes inflammatoires. Cell, 157, 1013-1022.
- Falle A, Hornung V, Petzold GC, Stewart CR, Monks BG, Reinheckel T, Fitzgerald KA, Latz E, Moore KJ & Golenbock DT. (2008). L'inflammasome Nalp3 est impliqué dans la réponse immunitaire innée à l'amyloïde-bêta. Nat. Immunol, 9: 857-865.
- Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernifeind FG, et al. (2010). Les inflammasomes NLRP3 sont nécessaires. Nature, 464 (7293): 1357-1361.
- Meinzer U, Quartier P, Alexandra J-F, Hentgen V, Retradez F, Koné-Paut I. (2011). Interleukin-1 ciblant les médicaments en fièvre méditerranéenne familiale: une série de cas et une revue de la littérature. Semin Arthrite Rheum, 41 (2): 265-271.
- Dupaul-Chicoine J, Yeretsian G, Doiron K, Bergstrom KS, McIntire CR, LeBlanc PM, et al. (2010). Contrôle de l'homéostasie intestinale, de la colite et du cancer colorectal asocé par la colite par les caspases inflammatoires. Immunité, 32: 367-78. Doi: 10.1016 / j.Immuni.2010.02.012

