Indien

- 1133
- 276
- Paul Dumas
 Pièce indienne métallique. Source: Images haute résolution d'éléments chimiques [cc par (https: // createVecommons.Org / licences / par / 3.0)]
Pièce indienne métallique. Source: Images haute résolution d'éléments chimiques [cc par (https: // createVecommons.Org / licences / par / 3.0)] Qu'est-ce que l'Indien?
Il Indien C'est un métal qui appartient au groupe 13 du tableau périodique et a un symbole chimique en. Votre numéro atomique est de 49, 49Dans, et est présenté dans la nature comme deux isotopes: 113Dans et 115Dans, ce dernier étant le plus abondant. Sur terre les atomes indiens se trouvent comme des impuretés dans le zinc et les minéraux principaux.
C'est un métal particulier, car il est le plus doux qui peut être touché sans beaucoup de risques pour la santé; Contrairement au lithium et au rubidium, qui brûlerait terriblement la peau en réagissant avec son humidité. Un morceau d'Indien peut être coupé avec un couteau et une fracture avec la force des doigts, émettant un croquant distinctif.
Celui qui entend ce métal viendra sûrement à l'esprit l'Inde, mais son nom découle de la couleur indigo, qui est observée lorsque le test de flamme est effectué. En ce sens, il semble beaucoup de potassium, brûlant son métal ou ses composés avec une flamme très caractéristique, à travers laquelle l'Indien a été détecté pour la première fois dans les minéraux de Sphenset.
L'Indien partage de nombreuses qualités chimiques avec de l'aluminium et du gallium, présentant dans la plupart des composés avec un nombre d'oxydation de +3 (en3+). Il se combine parfaitement avec la Gaule formant des alliages avec de faibles points de fusion, l'un d'eux étant le Galinstan.
Les applications indiennes sont basées sur la doublure des matériaux avec leurs alliages, ce qui en fait des conducteurs électriques et flexibles. L'Indien a du verre pour leur accorder de plus grandes paillettes, remplaçant l'argent. Dans le monde de la technologie, l'Indien se trouve sur les écrans tactiles et l'écran LCD.
Découverte
En 1863, le chimiste allemand Ferdinand Reich cherchait des traces de l'élément Talio, en utilisant la ligne verte de son spectre d'émission, dans les minéraux de CINC; Spécifiquement des échantillons de sphalérite (ZN) autour de la Saxe. Après avoir grillé les minéraux, retirer leur teneur en soufre, les digérer dans de l'acide chlorhydrique et distiller le chlorure de zinc, obtenu un précipité en pyjizo.
Compte tenu de la constatation, Reich a décidé d'effectuer une analyse spectroscopique; Mais parce qu'il n'avait pas de bons yeux pour observer les couleurs, il est allé voir son collègue Hariomus Theodor Richter pour l'aider dans cette tâche. Richter était celui qui a observé une ligne spectrale bleuâtre, qui ne correspondait pas au spectre d'un autre élément.
Il peut vous servir: acide d'iodose (HIO2): propriétés et utilisationsLes deux chimistes allemands faisaient face à un nouvel élément, qui était appelé la couleur indienne pour la couleur indigo de la flamme lorsque leurs composés ont brûlé; Et à son tour, le nom de cette couleur dérive du mot latin Indicum, Que signifie l'Inde.
Un an plus tard, en 1864, excité et après une série prolongée de précipitations et de purifications, ils ont isolé un échantillon d'Indien métallique par l'électrolyse de leurs sels dissous dans l'eau.
Structure indienne
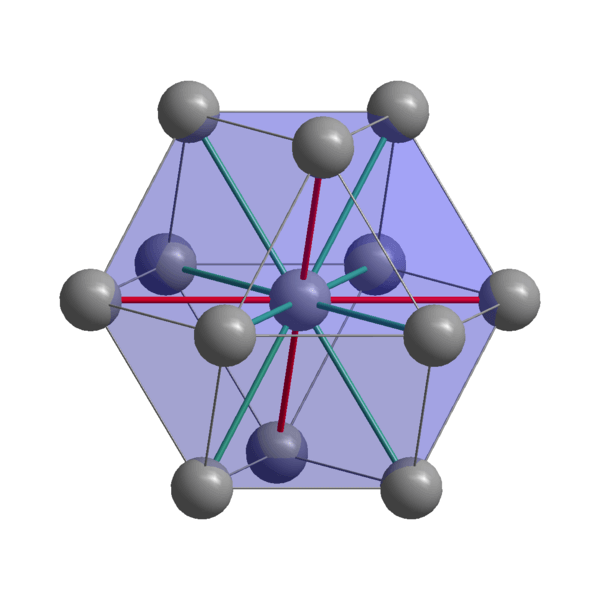 Structure cristalline indienne
Structure cristalline indienne Indian, in, atomes de cohésion utilisant leurs électrons de valence pour établir une liaison métallique. Ainsi, ils finissent par être ordonnés dans une structure tétragonale déformée centrée sur le corps. Les interactions entre les atomes en-en-en-neuf sont relativement faibles, ce qui explique pourquoi l'Indien a un faible point de fusion (156 ºC).
D'un autre côté, les forces qui unissent deux ou plusieurs cristaux indiens ne sont pas forts non plus, sinon ils ne se déplaceraient pas les uns sur les autres, conférant la douceur caractéristique du métal.
Propriétés indiennes
Apparence physique
C'est un métal argenté remarquablement doux. Il peut se déchirer avec la pression de l'ongle, coupé avec un couteau ou se gratter en coups lumineux sur une feuille de papier. Il est même possible de le mâcher et de le déformer avec les dents, à condition qu'il soit aplati. Il est également très ductile et malléable, ayant des propriétés en plastique.
Lorsque l'Indien chauffé avec une torche rejette une flamme d'une couleur indigo, encore plus brillante et plus colorée que celle du potassium.
Masse molaire
114,81 g / mol
Point de fusion
156,60 ºC
Point d'ébullition
2072 ºC.
Comme la Gaule, l'Indien a un grand intervalle de température entre son point de fusion et l'ébullition. Cela reflète le fait que les interactions in-in dans le liquide sont plus fortes que celles qui prédominent dans le verre; Et par conséquent, il est plus facile d'obtenir une goutte d'Inde que leurs vapeurs.
 Emplacement indien dans le tableau périodique. Source: Daniel Mayer ou Greatpatton Vectorisation: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Emplacement indien dans le tableau périodique. Source: Daniel Mayer ou Greatpatton Vectorisation: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Densité
À température ambiante: 7,31 g / cm3
Juste au point de fusion: 7,02 g / cm3
Électronégativité
1,78 sur l'échelle Pauling
Énergies d'ionisation
Premièrement: 558,3 kJ / mol
Deuxième: 1820,7 kJ / mol
Troisième: 2704 kJ / mol
Conductivité thermique
81,8 w / (m · k)
Résistivité électrique
83.7 nΩ · m
Dureté mohs
1.2. C'est à peine un peu plus dur que le talc (ne pas confondre la ténacité durement).
Réactivité
L'Indien se dissout dans les acides pour provoquer des sels, mais ne se dissout pas dans des solutions alcalines, même avec l'hydroxyde de potassium chaud. Réagit en contact direct avec le soufre, l'oxygène et les halogènes.
Peut vous servir: dilution: concept, comment il se fait, des exemples, des exercicesL'Indien est relativement amphotérique, mais se comporte plus comme une base que comme acide, étant ses solutions aqueuses légèrement basiques. Le in (oh)3 Il est redislove avec l'ajout d'alcalis plus provoquant des complexes indiatés, dans (OH)4-, Comme pour les aluminats.
Configuration électronique
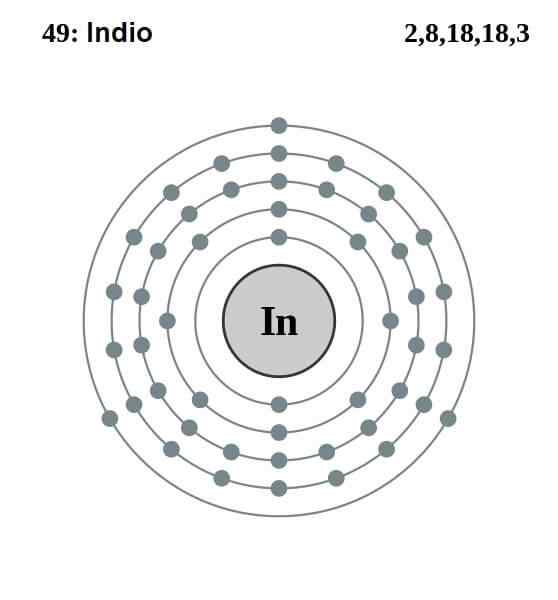 Configuration des Indiens électroniques
Configuration des Indiens électroniques La configuration électronique de l'Indien est la suivante:
[Kr] 4ddix 5s2 5 P1
Sur ces treize électrons, les trois derniers des orbitales 5s et 5p sont ceux de Valence. Avec ces trois électrons, les atomes indiens établissent leur liaison métallique, comme le fait l'aluminium et le gallium, et forment des liaisons covalentes avec d'autres atomes.
Nombres d'oxydation
Ce qui précède est utilisé pour rester tout de suite que l'Indien est en mesure de perdre ses trois électrons de Valence, ou de gagner cinq pour devenir isoléctronique au noble xénon à gaz noble.
Si dans un composé, nous supposons qu'il a perdu ses trois électrons, il restera le cation trivalent en3+ (En analogie al3+ et Ga3+) et, par conséquent, votre numéro d'oxydation sera +3. La plupart des composés indiens sont en (iii).
Parmi les autres nombres d'oxydation trouvés pour l'Inde, nous avons: -5 (en5-), -2 (en2-), -1 (en-), +1 (en+) et +2 (en2+).
Quelques exemples de composés en (i) sont: inf, incl, inbr, ini et in2SOIT. Tous sont des composés relativement rares, tandis que ceux de (iii) sont les prédominants: en (OH)3, Dans2SOIT3, Y compris3, Infirme3, etc.
Dans (i) les composés sont des agents réducteurs puissants, dans lesquels le+ faire don de deux électrons à d'autres espèces pour devenir3+.
Isotopes
L'Indien est présenté dans la nature comme deux isotopes: 113Dans et 115Dans, dont les abondances des terres sont respectivement de 4,28% et 95,72%. Par conséquent, sur terre, nous avons beaucoup plus d'atomes de 115À celui de 113Dans. Il 115En a une demi-vie de 4,41 · 1014 années, si grande qu'elle est pratiquement considérée comme stable, bien qu'elle soit radio-isotope.
À l'heure actuelle, un total de 37 isotopes artificiels de l'Inde, tous radioactifs et très instables ont été créés. De tous, le plus stable est le 111En, qui a une demi-vie de 2,8 jours.
Utilisations / applications
Alliages
L'Indien s'entend très bien avec le gallium. Les deux métaux forment des alliages que Mel. De plus, l'Indien est également facilement amalgame, ayant une solubilité de 57% dans le mercure.
Peut vous servir: acide acétique (CH3COOH)Les alliages indiens sont utilisés pour concevoir des miroirs en argent sans recourir à l'argent. Lorsqu'ils sont versés sur une zone de n'importe quel matériau, il agit comme un adhérent, de sorte que le verre, le métal, le quartz et la céramique peuvent être rassemblés.
électronique
 Sans l'Indien, les écrans tactiles n'auraient jamais existé
Sans l'Indien, les écrans tactiles n'auraient jamais existé L'Indien s'entend également avec Germanio, donc ses composés sont ajoutés comme dopant au nitruro germanique des LED, reproduisant ces mélanges Lumières bleues, violet et vert. Il fait également partie des transistors, des thermistances et des cellules photovoltaïques.
Le plus important de ses composés est l'oxyde d'étain et indien, qui est utilisé comme doublure en verre pour refléter certaines longueurs d'onde. Cela vous permet d'être utilisé dans les verres de soudage et dans le verre à gratter afin qu'ils ne chauffent pas à l'intérieur.
Le verre recouvert de cet oxyde est de bons conducteurs d'électricité; Comme celui de nos doigts. Et c'est pourquoi il est destiné à la fabrication d'écrans tactiles, encore plus d'activité actuelle en raison de l'émergence de plus en plus de smartphones.
Des risques
 Indien à l'état solide. Source: W. Oelen, CC BY-SA 3.0, via Wikimedia Commons
Indien à l'état solide. Source: W. Oelen, CC BY-SA 3.0, via Wikimedia Commons L'Indien ne représente aucun risque pour l'environnement en premier lieu, car il est dans les ions en3+ Ils ne sont pas diffusés en quantités appréciables. Il n'y a aucune information concernant son impact sur les sols, affectant les plantes, et ni dans la faune ou les mers.
Dans le corps, on ne sait pas si les ions3+ Ils ont une certaine participation essentielle au métabolisme en quantités de traces. Cependant, lorsque leurs composés sont ingérés, ils sont nocifs pour plusieurs organes, c'est pourquoi ils sont considérés comme des substances hautement toxiques.
En fait, les particules d'itoc (Tin et l'oxyde indien, pour son acronyme en anglais: L'oxyde d'étain indium), indispensable pour la fabrication d'écrans d'ordinateurs et de smartphones, ils peuvent avoir un impact négatif sur la santé des travailleurs, ce qui leur provoque une maladie appelée poumons indiens.
L'apport de ces particules se produit surtout par inhalation et par contact à travers la peau et les yeux.
D'un autre côté, les particules indiennes métalliques fines sont sujettes à brûler et à provoquer des incendies s'ils sont des clôtures une source de chaleur.

