Hydroxydes
- 2176
- 414
- Prof Noah Collet
Que sont les hydroxydes?
Les Hydroxydes Ce sont des composés inorganiques et ternaires qui se composent de l'interaction entre un cation métallique et le groupe fonctionnel OH (anion hydroxyde, OH-). La plupart d'entre eux sont de nature ionique, bien qu'ils puissent également avoir des liaisons covalentes.
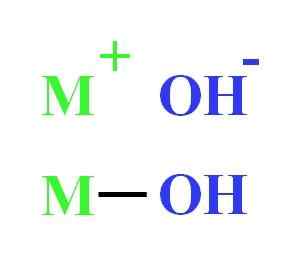
Par exemple, un hydroxyde peut être représenté comme une interaction électrostatique entre le cation m+ et anion oh-, ou comme l'union covalente via la liaison M-OH (image inférieure). Dans le premier, la liaison ionique est donnée, tandis que dans la seconde le covalent. Ce fait dépend essentiellement du métal ou du cation+, ainsi que sa charge et sa radio ion.
 Représentation d'hydroxyde. Source: Gabriel Bolívar
Représentation d'hydroxyde. Source: Gabriel Bolívar Parce que beaucoup d'entre eux viennent de métaux, il est équivalent de les mentionner sous forme d'hydroxydes métalliques.
Comment se forment les hydroxydes?
Il existe deux routes synthétiques principales: par réaction de l'oxyde correspondant avec l'eau, ou avec une base forte dans un milieu acide:
MO + H2O => M (OH)2
MO + H+ + Oh- => M (oh)2
Seuls ces oxydes métalliques solubles dans l'eau réagissent directement pour former l'hydroxyde (première équation chimique). D'autres sont insolubles et nécessitent des espèces acides qui libèrent m+, qui interagit ensuite avec l'OH- à partir de bases fortes (deuxième équation chimique).
Cependant, ces bases fortes sont NaOH, KOH et d'autres des métaux alcalins (lioh, rboh, csoh) hydroxydes de métal (CSOH). Ce sont des composés ioniques très solubles dans l'eau, donc leur oh- Ils sont libres de participer à des réactions chimiques.
D'un autre côté, il y a des hydroxydes de métal insolubles et par conséquent ce sont des bases très faibles. Même certains d'entre eux sont acides, comme c'est le cas avec l'acide tellurique, TE (OH)6.
L'hydroxyde établit un équilibre de solubilité avec le solvant autour de lui. S'il s'agit d'eau, par exemple, l'équilibre est ensuite exprimé comme suit:
M (oh)2 M2+(Ac) + oh-(AC)
Où (AC) indique que le milieu est aqueux. Lorsque le solide est insoluble, la concentration dissous est petite ou méprisable. Pour cette raison, les hydroxydes de métal insolubles ne peuvent pas générer des solutions aussi basiques que NaOH.
À partir de ce qui précède, il peut être déduit que les hydroxydes présentent des propriétés très différentes, liées à la structure chimique et aux interactions entre le métal et l'OH. Ainsi, bien que beaucoup soient ioniques, avec des structures cristallines variées, d'autres ont plutôt des structures polymères complexes et désordonnées.
Propriétés d'hydroxyde
Oh anion-
L'ion hydroxyle est un atome d'oxygène lié à un hydrogène. Ainsi, cela peut être facilement représenté comme oh-. La charge négative est située sur l'oxygène, faisant de cet anion un donneur d'espèces d'électrons: une base.
Si oh- Fait ses électrons à un hydrogène, une molécule H est formée2SOIT. Vous pouvez également donner vos électrons à des espèces de charges positives: en tant que centres métalliques m+. Ainsi, un complexe de coordination est formé via la liaison dative m-oh (l'oxygène fournit la paire d'électrons).
Cependant, pour que cela se produise, l'oxygène doit être capable de coordonner efficacement avec le métal, sinon, les interactions entre M et OH auront un caractère ionique marqué (M+ Oh-).
Peut vous servir: pipette volumétrique: caractéristiques, utilisations, étalonnage et erreursComme l'ion hydroxyle est le même dans tous les hydroxydes, la différence entre toutes réside dans le cation qui l'accompagne.
De même, comme ce cation peut provenir de tout métal du tableau périodique (groupes 1, 2, 14, 15, 16 ou les métaux de transition), les propriétés de ces hydroxydes varient considérablement, bien que tout le monde envisage en commun certains aspects.
Caractère ionique et basique
Les hydroxydes, bien qu'ils aient des liens de coordination, ont un caractère ionique latent. Dans certains, comme Naoh, ses ions font partie d'un réseau cristallin constitué par des cations nautiques+ Et oh anions- Dans les proportions 1: 1; c'est-à-dire pour chaque na ion+ Il y a un oh ion- de homologue.
Selon la charge métallique, il y aura plus ou moins d'anciens anions- autour de. Par exemple, pour un cation métal2+ Il y aura deux ions OH- interagir avec lui: m (oh)2, Qu'est-ce que des croquis comme ho- M2+ Oh-.
De la même manière qu'il se produit avec les métaux m3+ et avec d'autres charges plus positives (bien qu'elles dépassent rarement 3+).
Ce caractère ionique est responsable de nombreuses propriétés physiques, telles que la fusion et les points d'ébullition. Ceux-ci sont élevés, ce qui reflète les forces électrostatiques qui fonctionnent dans le réseau cristallin. De plus, lorsque les hydroxydes sont dissous ou fondues, ils peuvent effectuer un courant électrique en raison de la mobilité de leurs ions.
Cependant, tous les hydroxydes n'ont pas les mêmes réseaux cristallins. Ceux avec les plus stables seront moins enclins à se dissoudre dans des solvants polaires tels que l'eau. En règle générale, plus les radios ioniques de M sont disparates+ et oh-, plus soluble sera le même.
Tendance périodique
Ce qui précède explique pourquoi la solubilité des hydroxydes de métal alcalin augmente à mesure que le groupe descend. Ainsi, l'ordre croissant des solubilités dans l'eau pour ceux-ci est le suivant: lio OH- C'est un petit anion, et à mesure que le cation devient plus encombrant, le réseau cristallin affaiblit l'énergie. D'un autre côté, les métaux alcalinotherres forment des hydroxydes moins solubles en raison de leurs plus grandes charges positives. C'est parce que m2+ Il attire plus de force vers l'OH- par rapport à m+. De même, ses cations sont plus petites, et donc moins inégales par rapport à OH-. Le résultat de cela est la preuve expérimentale que NaOH est beaucoup plus basique que CA (OH)2. Le même raisonnement peut être appliqué à d'autres hydroxydes, soit pour ceux des métaux de transition, soit pour ceux du bloc P (AL, PB, TE, etc.). De plus, le rayon ionique plus petit et grand et la charge positive de m+, Le mineur sera le caractère ionique de l'hydroxyde, en d'autres termes, ceux qui ont des densités de charge très élevées. Un exemple de cela se produit avec l'hydroxyde de Beryl, be (oh)2. Il soit2+ C'est un très petit cation et sa charge divalent le rend électriquement très dense. M hydroxydes (OH)2 réagir avec les acides pour former un aquocomplexe, c'est-à-dire m+ extrémités entourées de molécules d'eau. Cependant, il existe un nombre limité d'hydroxydes qui peuvent également réagir avec les bases. Ce sont ceux qui sont connus sous le nom d'hydroxydes d'amphoteros. Les hydroxydes anfoter réagissent à la fois avec les acides et les bases. La deuxième situation peut être représentée avec l'équation chimique suivante: M (oh)2 + Oh- => M (oh)3- Mais comment déterminer si un hydroxyde est amphoter? À travers une expérience de laboratoire simple. Parce que de nombreux hydroxydes métalliques sont insolubles dans l'eau, ajoutant une base forte à une solution avec des ions m+ dissous, par exemple, pour3+, Il précipitera l'hydroxyde correspondant: Au3+(AC) + 3OH-(ac) => ah (oh)3(S) Mais avoir un excès d'OH- L'hydroxyde continue de réagir: Al (oh)3(s) + oh- => Al (oh)4-(AC) En conséquence, le nouveau complexe de charge négatif est solvé par les molécules d'eau environnantes, dissolvant l'hydroxyde d'aluminium blanc solide. Les hydroxydes qui restent inchangés avec l'ajout de base supplémentaire ne se comportent pas comme des acides et, par conséquent, ne sont pas amphotiques. Les hydroxydes peuvent avoir des structures cristallines similaires à celles de nombreux sels ou oxydes; quelques simples et autres très complexes. De plus, ceux où il y a une diminution du caractère ionique peut présenter des centres métalliques unis par des ponts d'oxygène (hom-o-moh). En solution, les structures sont différentes. Bien que pour des hydroxydes très solubles, il suffit de les considérer comme des ions dissous dans l'eau, pour d'autres, il est nécessaire de prendre en compte la chimie de la coordination. Ainsi, chaque cation m+ Il peut être coordonné à un nombre limité d'espèces. Plus il est encombrant, plus le nombre d'eau ou les molécules OH est grande- lié à lui. De là, survient la célèbre coordination octaèdre de nombreux métaux dissous dans l'eau (ou dans tout autre solvant): m (oh2)6+n, être égal à la charge métallique positive. CR (OH)3, Par exemple, vraiment un octaèdre. Comme? Considérant le composé comme [CR (oh2)3(OH)3], dont trois des molécules d'eau sont remplacées par des anions oh-. Si toutes les molécules étaient remplacées par OH-, Ensuite, la charge négative et le complexe de structure octaédrique [Cr (OH) seraient obtenus6]]3-. La charge -3 est le résultat des six charges négatives du OH-. Les hydroxydes peuvent être considérés comme des "oxydes hydratés". Cependant, en eux "l'eau" est en contact direct avec m+; dans les oxydes hydratés mo · nh2Ou, les molécules d'eau font partie d'une sphère de coordination externe (elles ne sont pas proches du métal). Ces molécules d'eau peuvent être extraites par le chauffage d'un échantillon d'hydroxyde: M (oh)2 + Q (chaleur) => mo + h2SOIT MO est l'oxyde métallique formé à la suite de la déshydratation d'hydroxyde. Un exemple de cette réaction est ce qui est observé lorsque l'hydroxyde cuprique, Cu (OH) est déshydraté2: Cu (oh)2 (bleu) + q => cuo (noir) + h2SOIT Quelle est la bonne façon de mentionner les hydroxydes? L'IUPAC a soulevé trois nomenclatures à cet effet: le traditionnel, le stock et le systématique. Il est correct d'utiliser l'un des trois, cependant, pour certains hydroxydes, il peut être plus confortable ou pratique de le mentionner d'une manière ou d'une autre. La nomenclature traditionnelle consiste simplement à ajouter la plus haute valence que le métal présente; Et le suffixe - juste le plus bas. Ainsi, par exemple, si le métal m a des valences +3 et +1, l'hydroxyde M (OH)3 Il s'appellera l'hydroxyde (nom de métal)ICO, tandis que le moh hydroxyde (nom de métal)ours. Pour déterminer ce que le Valencia en métal en hydroxyde est suffisant pour observer le nombre après OH enfermé entre parenthèses. Ainsi, m (oh)5 Cela signifie que le métal a une charge ou une valence de +5. La principale inconvénient de cette nomenclature, cependant, est qu'elle peut être compliquée pour les métaux avec plus de deux états d'oxydation (comme pour le chrome et le manganèse). Pour de tels cas, des hyper et hyper préfixes sont utilisés pour désigner les valences les plus élevées et les plus basses. Ainsi, si m au lieu d'avoir uniquement des valences +3 et +1, il a également +4 et +2, alors les noms de ses plus grands hydroxydes et valences moindres sont: l'hydroxyde hyper(Nom du métal)ICO, et hydroxyde hoquet(Nom du métal)ours. De toutes les nomenclatures, c'est le plus simple. Ici, le nom de l'hydroxyde est simplement suivi par le Valence du métal verrouillé entre parenthèses et écrit en numéros romains. Encore pour m (oh)5, Par exemple, sa nomenclature de stock serait: Hydroxyde (nom de métal) (V). (V) denota alors (+5). Enfin, la nomenclature systématique se caractérise par la recours à des préfixes multiplicateurs (di-, tri-, tétra, penta-, hexa-, etc.). Ces préfixes sont utilisés pour spécifier à la fois le nombre d'atomes métalliques et les ions OH-. De cette façon, le M (OH)5 Il est nommé: pentahidroxyde de (nom de métal). Dans le cas de HG2(OH)2, Par exemple, ce serait le dihydroxyde de dimercure; L'un des hydroxydes dont la structure chimique est complexe à première vue. Quelques exemples d'hydroxydes et leurs nomenclatures correspondantes sont celles qui suivent: -NaOH (hydroxyde de sodium) -CA (OH) 2 (hydroxyde de calcium) -Foi (OH)3 (Hydroxyde ferrique; hydroxyde de fer (III); ou trihydroxyde de fer). -V (oh)5 (Pervanate Hydroxyde; Hydroxyde de vanadium (V); ou pentahidroxyde de vanadium). -Sn (oh)4 (Hydroxyde Isñico; Hydroxyde d'étain (iv); ou tétrahydroxyde d'étain). -Ba (oh)2 (Hydroxyde de baryum ou dihydroxyde de baryum). -MN (OH)6 (Hydroxyde manganique, hydroxyde de manganèse (VI) ou hexahydroxyde de manganèse). -Augah (hydroxyde argique, hydroxyde d'argent ou hydroxyde d'argent). Notez que pour ce composé, il n'y a pas de distinction entre les actions et les nomenclations systématiques. -PB (OH)4 (Hydroxyde de Plúmbic, hydroxyde de plomb (IV) ou tétrahydroxyde de plomb). -Liop (hydroxyde de lithium). -CD (OH) 2 (hydroxyde de cadmium). -Ba (oh)2 (Hydroxyde de baryum). -Hydroxyde de chrome.Anfotérisme
Structure
Réaction de déshydratation
Nomenclature d'hydroxyde
Traditionnel
Action
Systématique
Exemples d'hydroxydes
 Apparence d'hydroxyde de sodium
Apparence d'hydroxyde de sodium  Aspect de l'hydroxyde de calcium à l'état solide
Aspect de l'hydroxyde de calcium à l'état solide Les références

