Alcynes
- 4034
- 1163
- Louna Baron
 Structure alvento, avec un triple lien
Structure alvento, avec un triple lien Que sont les alkines?
Les Alcynes Ce sont des hydrocarbures ou des composés organiques qui présentent dans leurs structures un triple lien entre deux carbones. Ce triple lien (≡) est considéré comme un groupe fonctionnel lorsqu'il représente un site actif de la molécule, et est donc responsable de leur réactivité.
Bien que les alcynes ne se différencient pas beaucoup d'Alko ou d'alcènes, ils présentent une plus grande acidité et polarité en raison de la nature de leurs liens. Le terme précis pour décrire cette légère différence est ce que l'on appelle insaturation.
Les alcanes sont des hydrocarbures saturés, tandis que les alcins sont les plus insaturés par rapport à la structure d'origine. Qu'est ce que ça signifie? Qu'un alcane h3C-ch3 (l'éthane) peut être déshydrogène à H2C = ch2 (enene) et par la suite HC≡CH (etino, ou mieux connu sous le nom d'acétylène).
Notez comment les liens supplémentaires sont formés parmi les carbones diminuent le nombre d'hydrogènes qui y sont liés. Le carbone, en raison de ses caractéristiques électroniques, cherche à former quatre liens simples, de sorte que plus la tendance à réagir est grande (à l'exception des composés aromatiques).
D'un autre côté, le triple lien est beaucoup plus fort que le double (=) ou l'obligation simple (-), mais à un coût énergétique élevé. Par conséquent, la plupart des hydrocarbures (alkans et alcènes) peuvent former des liaisons triples à des températures élevées.
En conséquence des hautes énergies de ceux-ci, lorsqu'ils se brisaient, ils se libérent très chauds. Un exemple de ce phénomène peut être vu lorsque l'acétylène brûle avec de l'oxygène et que la chaleur intense de la flamme pour souder ou faire fondre les métaux est utilisée.
L'acétylène est l'alcyne la plus simple et la plus petite de tous. D'autres hydrocarbures peuvent être exprimés à partir de leur formule chimique en remplaçant H par des groupes alquiliques (RC≡CR '). La même chose se produit dans le monde de la synthèse organique à travers un grand nombre de réactions.
Cette alcyne se produit à partir de la réaction de l'oxyde de calcium du calcaire et de la corde, matière première qui fournit les carbones nécessaires à l'intérieur d'un four électrique:
CAO + 3C => CAC2 + CO
Le cac2 C'est du carbure de calcium, un composé inorganique qui réagit enfin avec l'eau pour former de l'acétylène:
Cac2 + 2h2O => CA (OH)2 + HC≡CH
Propriétés physiques et chimiques des alkines
Polarité
Le triple lien distingue les alkines des alkans et des alcènes. Les trois types d'hydrocarbures sont apolaires, insolubles dans l'eau et des acides très faibles. Cependant, l'électronégativité des carbones à double et triple liaison est supérieure à celle des carbones simples.
Selon cela, les carbones adjacents à la triple liaison rendent à l'effet inductif densité de charge négative. Pour cette raison, où sont les liens C≡C ou C = C, il y aura une plus grande densité électronique que dans le reste du squelette gazéifié. En conséquence, il y a un petit moment dipolaire où les molécules interagissent par les forces dipolo-dipolo.
Ces interactions sont très faibles si leurs moments dipolaires sont comparés à ceux de la molécule d'eau ou de l'alcool. Cela se reflète dans leurs propriétés physiques: les alcins ont généralement des points de fusion et d'ébullition plus élevés par rapport à ceux de leurs hydrocarbures moins insaturés.
Peut vous servir: les 7 applications de biochimie les plus importantesDe même, en raison de leur faible polarité, ils sont moins insolubles dans l'eau, mais solubles dans les solvants organiques apolaires, comme le benzène.
Acidité
De plus, cette électronégativité provoque l'hydrogène HC≡Cr est plus acide que quiconque est présent dans d'autres hydrocarbures. Par conséquent, les alkines sont des espèces plus acides que les alcènes et bien plus que les alcanes. Cependant, son acidité reste méprisable par rapport à celle des acides carboxyliques.
Étant donné que les alkines sont des acides très faibles, ils ne réagissent qu'avec des bases très fortes, comme le sodium amiduro:
HC≡CR + NANH2 => HC≡CNA + NH3
De cette réaction, une solution d'acétylure de sodium est obtenue, matière première pour la synthèse d'autres alcynes.
Réactivité des alquinos
La réactivité des alcynes s'explique par l'ajout de petites molécules à leur triple lien, diminuant son insaturation. Il peut s'agir de molécules d'hydrogène, d'hallogénides d'hydrogène, d'eau ou d'halogènes.
Hydrogénation
La petite molécule H2 Il est très insaisissable et rapide, donc pour augmenter les chances d'être ajoutés au triple lien des alcins.
Ce sont généralement des métaux (Pd, Pt, Rh ou Ni) finement divisés pour augmenter la surface; Et de cette manière, le contact entre l'hydrogène et l'Alquino:
Rc≡cr '+ 2h2 => RCH2Ch2R '
Le résultat est que l'hydrogène est "ancre" aux carbones qui brisent une liaison, et ainsi de suite jusqu'à ce que l'alcane correspondant produise, RCH2Ch2R '. Cela sature non seulement l'hydrocarbure initial, mais modifie également sa structure moléculaire.
Ajout d'hydrogène halogogenuros
Ici, la molécule inorganique HX est ajoutée, où X peut être n'importe lequel des halogènes (F, Cl, Br ou I):
Rc≡cr '+ hx => rch = cxr'
Hydratation
L'hydratation d'alkines est lorsqu'ils ajoutent une molécule d'eau pour former un aldéhyde ou une cétone:
Rc≡cr '+ h2O => RCH2Cor '
Si R 'est un H, c'est un aldéhyde; S'il s'agit d'un loyer, alors c'est un Cetona. Dans la réaction, un composé connu sous le nom d'Enol (RCH = C (OH) R ') est formé comme un intermédiaire.
Cela subit une conversion de la forme éolienne (c-oh) en cétone (c = o) dans un équilibre appelé tautomérisation.
Ajout d'halogènes
Et en ce qui concerne les ajouts, les molécules diatomiques des halogènes peuvent également être ancrées aux carbones (x x2= F2, CL2, BR2 J'ai entendu2):
Rc≡cr '+ 2x2 => Rcx2-Cx2R '
Alkylation en acétylène
À partir de la solution d'acétylure de sodium, d'autres alkines peuvent être préparés en utilisant un halogénure de location:
HC≡CNA + RX => HC≡CR + Nax
Par exemple, s'il s'agissait de l'iodure de méthyle, alors l'alcyne résultant serait:
HC≡CNA + CH3I => hc≡cch3 + Nax
Hc≡cch3 est le bon, également connu sous le nom Méthyleacétylène.
Structure chimique des alkines
 Structure chimique de l'Alquino
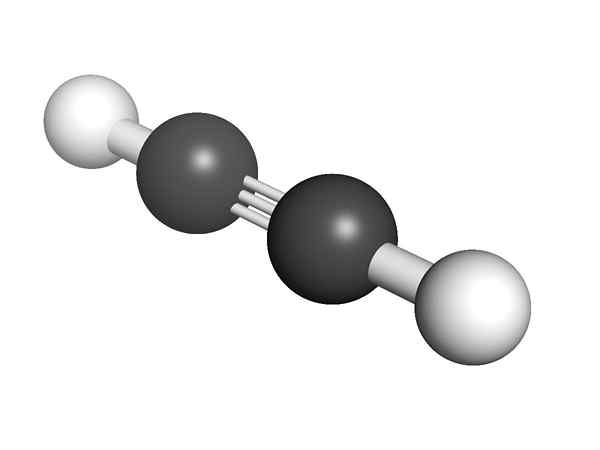
Structure chimique de l'Alquino Quelle est la structure des alcynes? Dans l'image supérieure, une molécule d'acétylène est représentée. La géométrie linéaire du lien C≡C peut en être claire.
Par conséquent, lorsqu'il y a une triple liaison, la structure de la molécule doit être linéaire. Ceci est une autre des différences notables entre eux et le reste des hydrocarbures.
Il peut vous servir: Cycopropane (C3H6)Les alcanes sont généralement représentés comme des zigzags, car ils ont une hybridation SP3 et leurs liens sont séparés 109º. Ils sont en fait une chaîne de tétraèdres unie covalente. Tandis que les alcènes sont plats par hybridation SP2 de ses carbones, formant plus spécifiquement un plan trigonal avec des liaisons séparées de 120º.
À Alkynes, l'hybridation orbitale est SP, c'est-à-dire qu'ils ont 50% de A S et 50% de A P. Il existe deux orbitales hybrides SP qui sont liées aux atomes H dans les groupes d'acétylène ou d'alcyne dans les alkines.
La distance H ou R est à 180 °, en plus du fait que ce n'est que de cette manière que les orbitales de carbones purs peuvent former le triple liaison. Pour cette raison, le lien -C≡C- est linéaire. Voir la structure de toute molécule que le -C≡C- met en évidence dans les régions où le squelette est très linéaire.
Distance des liens et de l'aumône terminal
Les carbones dans la triple liaison sont à une distance plus petite que dans le double ou le lien simple. En d'autres termes, C≡C est plus court que c = c et que c-c. En conséquence, le lien est plus fort car les deux liaisons π contribuent à stabiliser le lien simple σ.
Si la triple liaison est à la fin d'une chaîne, alors c'est un alcyne terminal. Par conséquent, la formule dudit composé doit être HC≡CR, où le H remarque la fin ou le début de la chaîne.
Si au contraire, c'est un triple lien interne, la formule est rc≡cr ', où r et r' sont le côté droit et gauche de la chaîne.
Nomenclature des alquinos
Comment les Alkines sont-elles nommées conformément aux règles dictées par l'IUPAC? De la même manière que les alquenos et les alcènes ont été nommés. Pour ce faire, le suffixe -ano ou -eno pour le suffixe -ino est modifié.
Par exemple: hc≡cch3 Il s'agit de conseils nommés, car il a trois carbones, comme le propane (CHO3Ch2Ch3). Le hc≡cch2Ch3 C'est le 1-Butino, qui est un alcyne terminal. Mais dans le cas de Cho3C≡Cch3 Ceci est le 2-Butino, et en cela le triple lien n'est pas terminal mais interne.
Le ch3C≡Cch2Ch2(Ch3)2 C'est 5-méthyl-2-hexine. Les carbones commencent du côté le plus proche du triple lien.
Un autre type d'alkines est les cycloalquins. Pour eux, il suffit de remplacer le suffixe -ano par -ino du cycloalcan correspondant. Ainsi, le cyclopropane qui a une triple liaison est nommé cyclopropine (qui n'existe pas).
Lorsqu'il y a deux triples liens, le préfixe DI est ajouté au nom-. Il a comme exemples de HC≡C-C≡H, du diacétylène ou de la propadine; Et à HC≡C-C-C≡H, Butadiino.
Alquinos utilise
Acétylène ou etino
La plus petite des alcynes épaississe le nombre possible d'utilisations pour ces hydrocarbures. De là à travers les Alks, d'autres composés organiques peuvent être synthétisés. Il subit également des réactions oxydatives pour obtenir de l'éthanol, de l'acide acétique, de l'acide acrylique, entre autres.
Peut vous servir: Hydrure de lithium: structure, propriétés, obtention, utilisationsD'autres utilisations consistent à fournir la source de chaleur pour exciter les électrons des atomes; plus spécifique, e de cations métalliques dans les déterminations par émission d'absorption atomique, technique spectroscopique largement utilisée.
Alkines naturelles
Les seules méthodes existantes pour préparer les alcynes sont non seulement synthétiques ou avec une application de chaleur en l'absence d'oxygène, mais aussi biologique.
Dans ces enzymes appelées acétylese, qui peut nier une double liaison. Grâce à cela, de nombreuses sources naturelles d'Alkynes sont réalisées.
Suite à cela, ces sources peuvent être extraites des poisons, des antidotes, des médicaments ou tout autre composé qui offre tout avantage; surtout quand cela concerne la santé. Les alternatives sont nombreuses lors de la modification de leurs structures d'origine et de les avoir comme support pour les nouveaux alkines.
Exemples d'alcynes
Jusqu'à présent, de nombreux exemples d'alkines ont été mentionnés. Cependant, certains proviennent de sources très spécifiques ou ont des structures moléculaires particulières: ce sont des polyacetyle.
Cela signifie qu'il peut y avoir plus d'un triple lien qui fait partie d'une très grande structure, et pas seulement d'une simple chaîne gazéifiée.
Acide taririque
 Structure d'acide taryrique
Structure d'acide taryrique L'acide taririque provient d'une plante située au Guatemala appelée Picramnia tariri. Il est spécifiquement extrait de l'huile de ses graines.
Dans sa structure moléculaire, un seul triple lien peut être observé qui sépare une queue apolaire d'une tête polaire; Par conséquent, il pourrait être considéré comme une molécule amphipatique.
Histrionicotoxine
 Structure de l'histrionicotoxine
Structure de l'histrionicotoxine L'histrionicotoxine est un poison séparé par la peau des habitants de la Colombie, du Brésil et d'autres pays d'Amérique latine. Il a deux liaisons conjuguées à triple avec une double liaison. Les deux sont des bornes et sont séparés par un anneau à six carbone et une amine cyclique.
Cicutoxine
 Structure de cicutoxine. Par giorgiogp2 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0) ou gfdl (http: // www.gnou.Org / copyleft / fdl.html)], de Wikimedia Commons
Structure de cicutoxine. Par giorgiogp2 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0) ou gfdl (http: // www.gnou.Org / copyleft / fdl.html)], de Wikimedia Commons De la structure moléculaire de la cicutoxine, où sont les triples liens? Si les doubles liaisons sont plates, car elles sont vues correctes, et que les liens simples sont des tétraédrales, comme aux extrémités, les triplets sont linéaires et sont sur la pente (\).
Ce composé se compose d'une neurotoxine trouvée principalement dans la plante de guérison aquatique.
Capillina
 Capillina Structure. Par Klever [CC0], de Wikimedia Commons
Capillina Structure. Par Klever [CC0], de Wikimedia Commons C'est un alcyne présent dans l'huile essentielle des plantes Artemis qui est utilisée comme agent antifongique. Deux liaisons consécutives triples peuvent être observées, plus correctement conjuguées.
Que signifie? Que les triples liaisons résonnent le long de toute la chaîne de carbone et implique que la double liaison C = O est ouverte à C-O-.
Pargiline
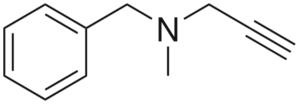 Structure de pargiline
Structure de pargiline C'est une alté. L'analyse de sa structure en parties est: un groupe de benchilo à gauche, une amine tertiaire au milieu et un lancement droit; c'est-à-dire un groupe de propriétés terminaux.
Les références
- Francis a. Écaille de tortue. Chimie organique. Acides carboxyliques. (Sixième édition., Page 368-397). Mc Graw Hill.
- Brennan, John. (10 mars 2018). Exemple d'alcynes. Science. Tiré de: science.com
- Byju's. (2018). Triple Bond en Alkynes. Pris de: byjus.com
- Encyclopédie des exemples (2017). Alcynes. Récupéré de: Exemples.co
- Kevin A. Boudeaux. Alcynes. Tiré de: Angelo.Édu
- Robert C. Neuman, Jr. Alcènes et alcynes. [PDF]. Tiré de: Chem.Ucr.Édu

