Structure d'hydroxyde de nickel (III), propriétés, utilisations, risques
- 3985
- 466
- Raphaël Meyer
Il Hydroxyde de nickel (III) C'est un composé inorganique où le métal nickel a un nombre d'oxydation de 3+. Sa formule chimique est ni (OH)3. Selon les sources consultées, jusqu'à présent, il n'a pas été possible de vérifier l'existence de l'hydroxyde de nickel (III) ou (OH)3, Mais l'oxo-hydroxyde de nickel (III), l'enfant (OH) a été obtenu.
Le nickel (iii) Nio (OH) oxohydroxyde est un solide cristallin noir qui cristallise de deux manières: la forme bêta et le gamma. La forme cristalline la plus courante (OH) est la version bêta.
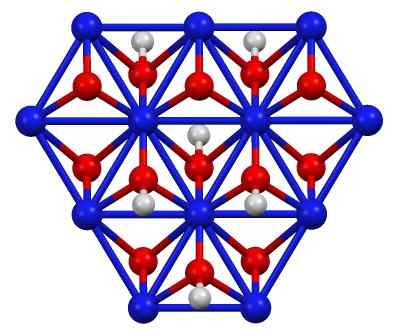
 Structure d'oxohydroxyde de nickel (III), enfant (OH). Bleu = nickel, rouge = oxygène, blanc = hydrogène. Auteur: Smokefoot. Source: propre travail. Source: Wikipedia Commons
Structure d'oxohydroxyde de nickel (III), enfant (OH). Bleu = nickel, rouge = oxygène, blanc = hydrogène. Auteur: Smokefoot. Source: propre travail. Source: Wikipedia Commons L'enfant (OH) peut être obtenu en oxydant les solutions de nitrate de nitrate (II) (ou (non3)2) avec du chlore (Cl2) ou brome (br2) En présence d'hydroxyde de potassium (KOH). Le nickel (III) l'oxohydroxyde est très soluble dans les acides. Il a une application dans les batteries en nickel, dans Superca.
Nickel (iii) Nio (OH) et Hydroxyde de nickel (II) ou (OH) (OH)2 Ils sont unis dans le fonctionnement de la plupart de leurs applications, car les deux font partie de la même équation de réduction de l'oxyde.
Étant un composé en nickel, l'enfant (OH) présente les mêmes risques d'autres sels de nickel, c'est-à-dire l'irritation cutanée ou la dermatite et le cancer.
[TOC]
Structure cristalline
L'oxohydroxyde de nickel (III) se cristallise de deux manières: bêta et gamma. La forme bêta β-nio (OH) a une structure très similaire à β-Ni (OH)2, ce qui semble logique car le premier vient de l'oxydation de ce dernier.
La forme gamma γ-nio (OH) est le produit d'oxydation de l'hydroxyde de nickel (II) sous sa forme alpha, α-ni (OH)2. Comme ce dernier, le gamma a une structure de couche avec des ions métalliques alcalins, des anions et de l'eau entrecoupées entre les couches.
Configuration électronique
Chez l'enfant (OH), le nickel se trouve dans l'état d'oxydation 3+, ce qui signifie que 3 électrons manquent à ses couches les plus externes, c'est-à-dire que deux électrons de la couche 4 manquents et un électron de la couche 3d. La configuration électronique de Ni3+ Dans l'enfant (oh) est: [ar] 3d7, Où [ar] est la configuration électronique du gaz argon noble.
Il peut vous servir: lien piNomenclature
- Nio (OH): Oxohydroxyde de nickel (III)
- Nickel noir
Propriétés
État physique
Solide cristallin noir.
Solubilité
L'oxohydroxyde Nio (OH) est très soluble dans les acides. La phase gamma se dissout dans l'acide sulfurique avec l'évolution de l'oxygène.
Autres propriétés
Dans l'eau chaude, il devient un oxohydroxyde de nickel (II) et (iii), ou3SOIT2(OH)4.
Il se décompose à 140 ºC dans le nickel (II) (enfant et oxyde d'oxygène.
La phase gamma (γ-nio (OH)) peut être obtenue de plusieurs manières, par exemple, le traitement du nickel avec un mélange fondu de peroxyde de sodium (Na2SOIT2) et l'hydroxyde de sodium (NaOH) à 600 ºC et le refroidissement dans l'eau glacée.
La phase gamma se décompose lorsqu'elle est chauffée à 138 ºC.
Applications
Dans les batteries en nickel
La batterie de nickel-hydrum d'Edison, dans laquelle KOH est utilisée comme électrolyte, est basée sur la réaction d'oxohydroxyde de nickel (III) avec du fer:
Télécharger:
Fe + 2nio (oh) + h2Ou ⇔ foi (oh)2 + 2ni (OH)2
Fardeau:
C'est une réaction réversible de réduction de l'oxyde.
Dans l'anode de ces batteries, une série de processus chimiques et électrochimiques se produit. Vous trouverez ci-dessous un schéma général:
Télécharger
β-ni (OH)2 ⇔ β-nio (OH) + H+ + et-
Fardeau
Vieillissement ↑ ↓ surcharge
Télécharger
α-ni (OH)2 ⇔ γ-nio (OH) + H+ + et-
Fardeau
Peut vous servir: Arsenic: histoire, structure, propriétés, utilisationsDans la technologie de la batterie de nickel, le nickel oxohydroxyde (iii) Nio (OH) est appelé "masse active de nickel".
 Batteries rechargeables en nickel. Auteur: SuperUsergerneric. Source: propre travail. Source: Wikipedia Commons.
Batteries rechargeables en nickel. Auteur: SuperUsergerneric. Source: propre travail. Source: Wikipedia Commons. En électrocatalyse en tant que catalyseur régénérable
L'enfant (OH) a été utilisé avec succès dans l'électrosynthèse des azopirazoles, à travers l'oxydation électrocatalitique des aminopyrazoles. Son utilité dans la synthèse des acides carboxyliques à partir d'alcools ou de composés carbonyle a également été prouvé.
 Obtention d'un acide carboxylique en oxydant un alcool catalysé par l'enfant (OH). Source: originaire de dans.Wikipédia. Le téléchargeur d'origine était v8rik en.Wikipédia. Source: Wikipedia Commons
Obtention d'un acide carboxylique en oxydant un alcool catalysé par l'enfant (OH). Source: originaire de dans.Wikipédia. Le téléchargeur d'origine était v8rik en.Wikipédia. Source: Wikipedia Commons Un autre exemple est celui de la conversion quantitative de l'hydroxyméthypyridine en acide pyridocarboxylique. Dans ce cas, l'électrode en acier ou en nickel correspondant à l'anode est recouverte d'une couche d'enfant (OH). Le milieu dans lequel l'électrolyse est effectuée est alcaline.
Dans ces réactions, l'enfant (OH) agit comme un médiateur de réduction-extérieur, ou médiateur «redox».
L'électrolyse est réalisée dans une cellule avec de l'anode nickel et de la cathode en titane, dans un milieu alcalin. Pendant le processus, il est formé ou (OH)2 À la surface de l'anode nickel, qui est rapidement oxydé à l'enfant (OH):
Ni (oh)2 + Oh- - et- ⇔ nio (oh) + h2SOIT
L'enfant (OH) réagit avec le substrat organique et le produit organique souhaité est obtenu, régénérant le Ni (OH)2:
Nio (OH) + composé organique → Ni (OH)2 + produit
Quand le ni (oh) se régénère2, La réaction de catalyse continue.
L'utilisation de l'enfant (OH) comme électrocatiseur permet d'obtenir des composés organiques à faible coût et de manière respectueuse de l'environnement.
Dans Super Cardpisors
L'enfant (oh) avec le ni (oh)2 Ils constituent d'excellents matériaux pour les électrodes superchaitées (anglais Supercapitos).
Ni (oh)2 + Oh- ⇔ nio (oh) + h2Ou + e-
Ils ont une capacité élevée, un faible coût et, selon certaines références, sous un impact environnemental.
 Condenseurs dans un circuit électronique. Auteur: pdphotos. Source: Pixabay.
Condenseurs dans un circuit électronique. Auteur: pdphotos. Source: Pixabay. Cependant, ils ont une faible conductivité. Ceci est résolu à l'aide de nanoparticules de ces composés, car augmente ainsi la surface et diminue la distance requise pour la diffusion, ce qui assure une vitesse élevée de transfert d'électrons et / ou d'ions.
Peut vous servir: matériaux élastiquesEn oxydation des ions métalliques
L'une des applications commerciales de l'oxohydroxyde de nickel (III) est basée sur sa capacité à oxyder les ions de cobalt (ii) en solution aux ions de cobalt (III).
Des risques
En solution, le nickel est plus stable comme un ion ou2+, Par conséquent, il n'est pas habituel d'entrer en contact avec Ni3+. Cependant, les précautions sont les mêmes, car le nickel, qu'ils soient métalliques, en solution ou sous la forme de ses sels solides, peuvent provoquer une sensibilisation à la peau.
Il est conseillé d'utiliser des équipements de protection et des vêtements, tels que le bouclier facial, les gants et les chaussures de sécurité. Tout cela doit être utilisé à chaque fois qu'il y a la possibilité d'entrer en contact avec des solutions nickel.
Si la dermatite se produit, elle doit être traitée avec un médecin pour exclure qu'elle est causée par le nickel.
Quant à la possibilité d'inhalation, c'est une bonne pratique.
Tous les composés en nickel sont classés par l'International Cancer Research Agency, ou CIRC (acronyme pour l'anglais Agence internationale pour la recherche sur le cancer), dans la catégorie des cancérogènes pour l'être humain.
Ceci est basé sur des données épidémiologiques et expérimentales.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Lyalin, B.V. et al. Électrosynthèse des azopyrarazoles via l'oxydation des N-alkylaminopyrazoles sur une anode enfant (OH) dans une méthode aqueuse alcali-A verte pour les homocouple N-N. Lettres de tétraèdre. 59 (2018) 2741-2744. Récupéré de ScienceDirect.com.
- Liuyang, Zhang, et al. (2018). Matériaux à base de nickel pour Supercapitos. Matériaux aujourd'hui. Récupéré de ScienceDirect.com
- Ettel, V.POUR. et mosolu, m. POUR. (1977). Préparation du nickel noir. OU.S. Brevet non. 4 006,216. 1er février 1977.
- Scharbert, b. (1993). Processus d'oxydation des dérivés d'hydroxyméthylpyridine en dérivés d'acide pyridinecarboxylique aux anodes d'hydroxyde d'oxyde de nickel. OU.S. Brevet non. 5 259 933. 9 novembre 1993.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 17. Quatrième édition. John Wiley & Sons.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume à 17. VCH VERLAGSGELLSCHAFT MBH.
- McBreen, James. (1997). Hydroxydes de nickel. Dans Handbook of Batter Materials. Éditeur VCH. Récupéré d'osti.Gouvernement.
- « Historique des macro-ordinateurs, caractéristiques, utilisations, exemples
- Ordinateurs analogiques en vedette, composants, types »

