Hydroxiapatite

- 2169
- 433
- Raphaël Charles
Nous expliquons ce qu'est l'hydroxylapatite, sa structure, comment elle est synthétisée, ses utilisations et ses propriétés physiques et chimiques
 Hydroxiapatite. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, via Wikimedia Commons
Hydroxiapatite. Source: Rob Lavinsky, Irocks.com-cc-by-sa-3.0, cc by-sa 3.0, via Wikimedia Commons Qu'est-ce que l'hydroxyapatite?
La Hydroxiapatite C'est un minéral de phosphate de calcium, dont la formule chimique est CAdix(Po4)6(OH)2. Avec d'autres minéraux et de la matière organique organique et compacte, il forme la matière première connue sous le nom de roche phosphorique. Le terme hydroxi fait référence à l'anion oh-.
Si au lieu de cet anion était du fluor, le minéral serait appelé fluoroapatita (CAdix(Po4)6(F)2; Et donc avec d'autres anions (CL-, BR-, CO32-, etc.). De même, l'hydroxyapatite est la principale composante inorganique des os et de l'émail dentaire, principalement présent dans un cristallin.
Donc, c'est un élément vital dans les tissus osseux des êtres vivants. Sa grande stabilité contre d'autres phosphates de calcium lui permet de soutenir les conditions physiologiques, donnant aux os leur dureté caractéristique. L'hydroxiapatite n'est pas seule: elle remplit sa fonction accompagnée de collagène, protéine fibreuse des tissus conjonctifs.
L'hydroxyapatite (ou l'hydroxylapatite) contient des ions CA2+, Mais d'autres cations peuvent également se nourrir dans sa structure (Mg2+, N / A+), Impuretés impliquées dans d'autres processus biochimiques des os (comme leur remodelage).
Structure d'hydroxyapatite
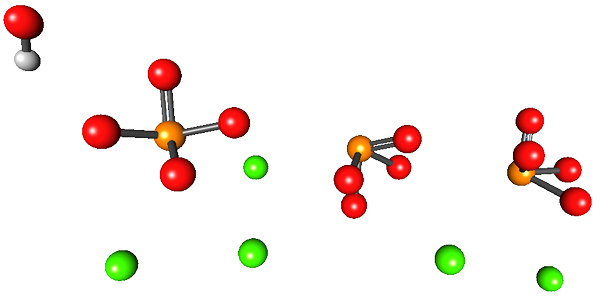
L'image supérieure illustre la structure de l'hydroxyapatite de calcium. Toutes les sphères occupent le volume de la moitié d'un "tiroir" hexagonal, où l'autre moitié est identique au premier.
Dans cette structure, les sphères vertes correspondent aux cations2+, Tandis que les sphères rouges aux atomes d'oxygène, orange aux atomes de phosphore, et le blanc à l'atome d'hydrogène OH-.
Les ions phosphates dans cette image ont le défaut de ne pas afficher une géométrie tétraédrique; Au lieu de cela, ils semblent être des pyramides de base carrée.
Peut vous servir: État vitreuxOH- donne l'impression qu'il est situé loin du CA2+. Cependant, l'unité cristalline peut se répéter sur le toit du premier, montrant ainsi la proximité étroite entre les deux ions. De plus, ces ions peuvent être remplacés par d'autres (na+ et f-, par exemple).
Synthèse d'hydroxylapatite
L'hydroxylapatite peut être synthétisée par réaction de l'hydroxyde de calcium avec de l'acide phosphorique:
10 Ca (OH)2 + 6 h3Pote4 => CAdix(Po4)6(OH)2 + 18 h2SOIT
Hydroxiapatita (CAdix(Po4)6(OH)2) est exprimé par deux unités de formule CA5(Po4)3Oh.
De même, l'hydroxyapatite peut être synthétisée par la réaction suivante:
10 CA (non3)2.4h2O + 6 NH4H2Pote4 => CAdix(Po4)6(OH)2 + 20 NH4NON3 + 52 h2SOIT
Contrôle la vitesse de précipitation permet à cette réaction de générer des nanoparticules d'hydroxyapatite.
Cristaux d'hydroxyapatite

Les ions sont compactés et se développent pour former un bio-critique rigide et résistant. Ceci est utilisé comme biomatériau de la minéralisation osseuse.
Cependant, il a besoin de collagène et de soutien organique qui sert de moule de sa croissance. Ces cristaux et leurs processus de formation compliqués dépendront de l'os (ou de la dent).
Ces cristaux se développent imprégnés de matière organique, et l'application de techniques de microscopie électronique les détaille les dents comme des agrégats avec des formes de tige appelées prismes.
Utilisations d'hydroxylapatite
Utilisation médicale et dentaire
En raison de sa similitude de taille, de cristallographie et de composition avec le tissu humain dur, la nanohydroxyapatite est attrayante à utiliser dans les prothèses. De plus, la nanohydroxyapatite est biocompatible, bioactive et naturelle, en plus de ne pas être toxique ou inflammatoire.
Par conséquent, la céramique nanohydroxyapatite a une variété d'applications, notamment:
- En chirurgie de Tejido, il est utilisé dans la garniture des cavités dans les chirurgies orthopédiques, traumatologiques, maxillo-faciales et dentaires.
- Il est utilisé comme revêtement d'implants orthopédiques et dentaires. C'est un agent désensibilisant utilisé pour le blanchiment dentaire. Il est également utilisé comme agent de réceptionnalisation dans les pâtes dentaires et le traitement des caries précoces.
- Les implants en acier inoxydable et en titane sont souvent recouverts d'hydroxyapatite pour réduire leur vitesse de rejet.
- C'est une alternative aux greffes d'os alogènes et xénogéniques. Le temps de guérison est plus court en présence d'hydroxyapatite qu'en son absence.
- Nanohidroxyapatite synthétique Mimétiza à l'hydroxyapatite présente naturellement dans la dentine et l'apatite enmaltique, de sorte que son utilisation dans la réparation de l'émail et l'incorporation dans les pâtes dentaires est avantageuse, ainsi que dans les rinçages de la bouche.
Autres utilisations de l'hydroxyapatite
- L'hydroxyapatite est utilisée dans les filtres à air des véhicules à moteur pour augmenter leur efficacité dans l'absorption et la décomposition du monoxyde de carbone (CO). Cela réduit la pollution de l'environnement.
- Un complexe d'alginate-hydroxyapatite a été synthétisé que des tests sur le terrain ont indiqué qu'il est capable d'absorber le fluorure à travers le mécanisme d'échange d'ions.
- L'hydroxiapathe est utilisée comme milieu chromatographique pour les protéines. Cela a des frais positifs (CA++) et négatif (po4-3), il peut donc interagir avec des protéines chargées électriquement et permettre sa séparation par échange d'ions.
- L'hydroxyapatite a également été utilisée comme support pour les acides nucléiques électrophotiques. Il est possible de séparer l'ADN de l'ARN, ainsi que l'ADN d'un simple brin de l'ADN à deux brins.
Proprietes physiques et chimiques
L'hydroxyapatite est un solide blanc qui peut acquérir des tons gris, jaune et verdâtre. Comme un solide cristallin, il présente des points de fusion élevés, indiquant les fortes interactions électrostatiques; Pour l'hydroxyapatite, c'est 1100 ºC.
Il est plus dense que l'eau, avec une densité de 3,05 à 3,15 g / cm3. De plus, il est pratiquement insoluble dans l'eau (0,3 mg / ml), qui est dû aux ions phosphates.
Cependant, dans les milieux acides (comme dans HCl), il est soluble. Cette solubilité est due à la formation de CACL2, Sel d'eau très soluble. De même, les phosphates sont du proton (HPO42- et h2Pote4-) et interagir à une meilleure mesure avec l'eau.
La solubilité de l'hydroxyapatite acide est importante dans la physiopathologie des caries. Les bactéries dans la cavité buccale sécrètent l'acide lactique, le produit de la fermentation du glucose, qui diminue le pH de la surface dentaire à moins de 5, de sorte que l'hydroxyapatite commence à se dissoudre.
Peut vous servir: sublimation: concept, processus et exemplesLe fluorure (f-) Vous pouvez remplacer les ions OH- Dans la structure cristalline. Lorsque cela se produit, il assure une résistance à l'hydroxyapatite de l'émail dentaire devant les acides.
Peut-être, cette résistance peut être due à l'insolubilité du CAF2 formé, refusant de "quitter" le verre.
Les références
- Fhiver & Atkins. (2008). CHIMIE INORGANIQUE. (Quatrième Ed., p. 349, 627). Mc Graw Hill.
- Fluidinova. (2017). Hydroxylapatite. Récupéré de Fluidinova.com
- Gaiabulbanix. (5 novembre 2015). Hydroxyapatite. [Chiffre]. Récupéré des communes.Wikimedia.org
- Martin.Neitsov. (25 novembre 2015). Hüdroksüapatiidi Kristallid. [Chiffre]. Récupéré des communes.Wikimedia.org
- Wikipédia. (2018). Hydroxylapatite. Récupéré de.Wikipédia.org
- Fiona Petchey. Os. C14dating récupéré.com

