Hydrogénation catalytique
- 4413
- 1242
- Jade Duval
 L'hydrogénation catalytique est une réaction chimique où le résultat final est l'ajout d'hydrogène à un autre composé. Source: Gabriel Bolívar
L'hydrogénation catalytique est une réaction chimique où le résultat final est l'ajout d'hydrogène à un autre composé. Source: Gabriel Bolívar Qu'est-ce que l'hydrogénation catalytique?
La hydrogénation catalytique C'est la réaction chimique par laquelle l'hydrogène moléculaire est ajouté dans un composé à des vitesses plus élevées.
La molécula H2 Non seulement doit d'abord rompre sa liaison covalente, mais aussi, être si petite et efficace entre elle et le composé à l'endroit où il sera ajouté sont moins probables.
Le composé des récepteurs d'hydrogène peut bien être organique ou inorganique. Dans les composés organiques, ils sont là où il existe la plupart des exemples d'hydrogénation catalytique, en particulier ceux qui ont une activité pharmacologique, ou ont des métaux incorporés dans leurs structures (composés organométalliques).
Quand h est ajouté2 À une structure pleine de carbone, ce qui se passe, c'est que son insaturation diminue, c'est-à-dire que le carbone atteint le degré maximum de liens simples qu'il peut former.
Par conséquent, H2 Des liens doubles (c = c) et triple (C≡C) sont ajoutés, bien qu'il puisse également être ajouté aux groupes de carbonil (c = o).
Ainsi, les alcènes et les alkines réagissent par hydrogénation catalytique. Analysant superficiellement n'importe quelle structure, on peut prédire s'il ajoutera ou non H2 détecter juste les liens doubles et triples.
Caractéristiques de l'hydrogénation catalytique
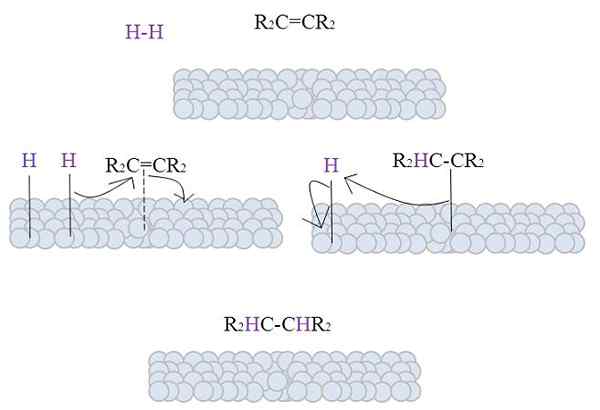
L'image montre le mécanisme de cette réaction. Cependant, il est nécessaire de traiter certains aspects théoriques avant de le décrire.
Les surfaces des sphères grises représentent les atomes métalliques qui, comme nous le verrons, sont les catalyseurs de l'hydrogénation par excellence.
Rupture de liaison hydrogène
- L'hydrogénation est une réaction exothermique, c'est-à-dire qu'elle libère la chaleur à la suite de la formation de composés énergétiques inférieurs.
Peut vous servir: acétanylide (C8H9NO)- Les liaisons C-H formées sont stables, qui nécessitent une plus grande énergie pour une rupture ultérieure que la liaison H-H des besoins d'hydrogène moléculaire.
- L'hydrogénation implique toujours d'abord la rupture du lien H-H. Cette rupture peut être homolitique, comme dans de nombreux cas:
H-h => h ∙ + ∙ h
Ou hétérolytique, qui peut être donné, par exemple, lorsque l'oxyde de zinc est l'hydrogène, ZnO:
H-h => h+ + H-
- La différence entre les deux ruptures réside dans la répartition des électrons de liaison. S'ils sont distribués de manière égale (de manière covalente), chaque H finit par retenir un électron, tandis que si la distribution est ionique, on se termine sans électrons, H+, Et l'autre les gagne complètement, h-.
- Les deux ruptures sont possibles dans l'hydrogénation catalytique, bien que l'homolithique permet de céder la place au développement d'un mécanisme logique pour cela.
Expérimental
- L'hydrogène est un gaz, et par conséquent, il doit être pétillant et garantir que lui seul prédominait à la surface du liquide.
- Le composé hydrogène doit être solubilisé dans un milieu, que ce soit de l'eau, de l'alcool, de l'éther, des esters ou une amine liquide. Sinon, l'hydrogénation passerait très lentement.
Dissous le composé en hydrogène, il doit également y avoir un catalyseur dans le milieu de réaction. Ce sera responsable de l'accélération de la vitesse de la réaction.
- Dans l'hydrogénation catalytique, les métaux finement divisés du nickel, du paladium, du platine ou du rhodium sont généralement utilisés, qui sont insolubles dans presque tous les solvants organiques. Par conséquent, il y aura deux phases: un liquide avec le composé et l'hydrogène dissous, et un solide, celui du catalyseur.
Il peut vous servir: Cruise for Crucible: Caractéristiques, fonctions, utilisez des exemples- Ces métaux fournissent leur surface pour que l'hydrogène et le composé réagissent, de sorte que les ruptures de liaison sont accélérées.
- Ils diminuent également l'espace de diffusion de l'espèce, augmentant le nombre de collisions moléculaires efficaces. Non seulement cela, mais même la réaction se déroule dans les pores du métal.
Types d'hydrogénation catalytique
Homogène
On parle d'hydrogénation catalytique homogène lorsque le milieu de réaction se compose d'une seule phase. Ici l'utilisation de métaux dans leurs états purs, car ils sont insolubles.
Au lieu de cela, les composés organométaux de ces métaux sont utilisés, qui sont solubles et se sont avérés avoir des rendements élevés.
L'un de ces composés organométalliques est le catalyseur Wilkinson: le chlorure de Tris (trifénylphine) Rodio, [(C6H5)3P]3Rhcl.
Ces composés forment un complexe avec H2, L'activer pour son ajout ultérieur à l'alcène ou à l'alquino.
L'hydrogénation homogène présente beaucoup plus d'alternatives que hétérogènes, car la chimie dans les composés organométalliques est abondante: il suffit de changer le métal (Pt, Pd, Rh, Ni) et les ligands (les molécules organiques ou inorganiques liées au centre métallique), à Obtenez un nouveau catalyseur.
Hétérogène
L'hydrogénation catalytique hétérogène, comme je viens de mentionner, a deux phases: un liquide et un solide.
En plus des catalyseurs métalliques, il y en a d'autres qui se composent d'un mélange solide. Par exemple, le catalyseur Lindlar, qui est composé de platine, de carbonate de calcium, d'acétate de plomb et de quinoline.
Le catalyseur Lindlar a la particularité qu'il est pauvre pour l'hydrogénation des alcènes. Cependant, il est très utile pour les hydrogénations partielles, c'est-à-dire qu'elle fonctionne parfaitement sur les alkines:
Peut vous servir: Lutecio: structure, propriétés, utilisations, obtentionRc≡cr + h2 => Rhc = chr
Mécanisme
L'image montre le mécanisme de l'hydrogénation catalytique à l'aide d'un métal en poudre comme catalyseur.
Les sphères grises correspondent à la surface métallique de, pour dire, en platine. La molécule H2 (couleur violette) est proche de la surface métal2C = cr2.
Le H2 Interaction avec les électrons qui parcourent les atomes métalliques, et une rupture et une formation d'un lien temporel H-M se produisent, où m est le métal. Ce processus est connu comme chimisorption. C'est-à-dire une adsorption par les forces chimiques.
L'alcène interagit de manière similaire, mais le lien le forme avec sa double liaison (ligne pointillée).
La liaison H-H s'est déjà dissociée et chaque atome d'hydrogène reste lié au métal. De même, il le fait avec des centres métalliques dans les catalyseurs organométalliques, formant un complexe intermédiaire H-M-H.
Il se produit ensuite une migration de A H vers la double liaison, et cela ouvre la formation d'un lien avec le métal. Ensuite, le H restant rejoint l'autre carbone de la double liaison originale, et l'alcane produit est enfin libéré, R2HC-chr2.
Ce mécanisme sera répété autant de fois que nécessaire, jusqu'à ce que tout soit2 ont complètement réagi.
Les références
- Carey, F. (2008). Chimie organique. Mc Graw Hill.
- Shiver & Atkins (2008). Chimie inorganique. Mc Graw Hill.
- Lew, J. (s.F.). Hydrogénation catalytique des alcènes. Chem récupéré.Bibliothèque.org
- Qu'est-ce que l'hydrogénation catalytique? - Mécanisme et réaction. L'étude a récupéré.com

