Hydrocarbures insaturés
- 3749
- 449
- Raphaël Charles
Nous expliquons quels hydrocarbures insaturés, leur classification, les propriétés, la nomenclature et les donnent plusieurs exemples sont
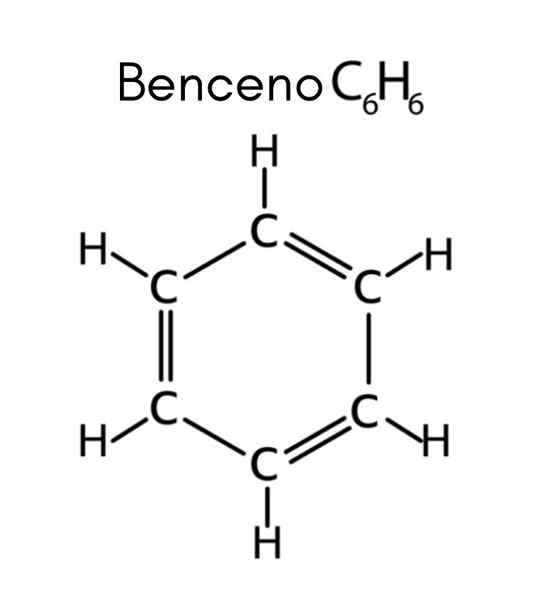
 Le benzène est un exemple d'hydrocarbure insaturé
Le benzène est un exemple d'hydrocarbure insaturé Que sont les hydrocarbures insaturés?
Les hydrocarbures insaturés Ce sont des composés organiques qui ne sont formés que par le carbone et l'hydrogène, qui ont une ou plusieurs liaisons entre les atomes de carbone. Cela signifie que n'importe quel composé de formule CXHet qui présente un double ou une triple liaison est un hydrocarbure insaturé.
Les hydrocarbures insaturés sont formés par des alcènes et des alkines, ainsi que des composés aromatiques. La raison pour laquelle ils sont insaturés est parce qu'ils ont un plus petit nombre d'hydrogènes que le maximum qu'ils pourraient avoir, étant donné le nombre d'atomes de carbone dans la structure.
Les hydrocarbures insaturés sont reconnus en ayant moins de 2N + 2 hydrogènes (qui est le nombre maximum d'hydrogènes qui peuvent être du carbone), où n est le nombre d'atomes de carbone dans la formule moléculaire.
Un exemple d'hydrocarbure insaturé est le butteno, dont la formule moléculaire est c4H8. Le nombre maximum d'hydrogènes pour 4 carbones serait 2 (4) +2 = 10 hydrogènes. Cela correspond au nombre d'hydrogènes d'un hydrocarbure saturé. Comme le Buteno n'a que 8 hydrogènes, qui est inférieur à 10, alors il s'agit d'un hydrocarbure insaturé.
Le nombre d'insaturation
Les hydrocarbures insaturés sont caractérisés par le nombre d'insaturation. Cela indique que le nombre de paires d'hydrogène inférieur à un hydrocarbure insaturé est comparé à celui saturé qui possède le même nombre de carbones.
Le nombre d'insaturation peut être calculé pour tout composé insaturé au moyen de la formule suivante:
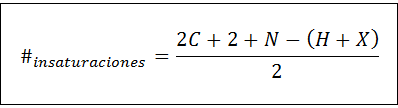
Où c, n, h et x représentent le nombre de carbones, de nitrogènes, d'hydrogènes et d'halogènes dans la formule moléculaire, respectivement. Ce nombre nous donne une idée du nombre de doubles ou de liaisons triples a un composé, étant donné sa formule moléculaire, bien que les soins doivent être pris en compte parce que les cycles (qui ne sont pas insaturés) contribuent également au nombre d'insaturation:

Exemple
Le benzène a la formule C6H6, Le nombre d'insaturation est donc:
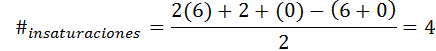
Dans ce cas, la 4 insaturation correspond à trois doubles liens et à un cycle.
Classification des hydrocarbures insaturés
Selon le type d'hydrocarbure
- Alcènes: Ce sont ceux qui ont au moins un double lien dans leur structure.
- Alkynes: Ce sont ceux qui ont au moins un triple lien dans leur structure.
- Aromatique: Ce sont des composés polyinsaturés cycliques avec des propriétés spéciales qui les rendent particulièrement stables.
Selon la chaîne de carbone
- Linéaire: composés insaturés dans lesquels tous les atomes de carbone sont liés les uns aux autres dans une seule chaîne.
- Ramifié: Ce sont ceux qui ont une chaîne principale et aussi plusieurs chaînes latérales qui forment des ramifications.
- Cyclique: Ce sont ceux dans lesquels un cycle fermé d'atomes de carbone est présenté dans lequel au moins une double ou triple liaison est présentée (Cycloalquenos, Cycloalquinos et aromatique).
Selon le nombre d'insaturation
- Monoinsaturé: Quand ils n'ont qu'un lien multiple, c'est-à-dire une seule double liaison ou un seul triple lien.
- Polynsaturé: Lorsque la structure a plus d'un lien multiple, comme dans le cas de l'Alkian, de l'Alkian, des Alcenins, etc.
Propriétés des hydrocarbures insaturés
Les propriétés des hydrocarbures insaturés dépendent fortement du type particulier d'hydrocarbure en question:
Points de fusion et d'ébullition
En général, les hydrocarbures insaturés ont de faibles points de fusion et d'ébullition. Cependant, par rapport aux alcanes, les alcènes avec le même nombre de carbones et la chaîne principale similaire ont généralement un point d'ébullition plus bas.
Il en va de même pour les points de fusion. Dans le tableau suivant, on peut voir que le point de fusion et l'ébullition de 1 pentène sont inférieurs à ceux du pentan et ceux que ceux du 1-petino.

État physique
En raison de ses faibles points de fusion et d'ébullition, les hydrocarbures insaturés à faible poids moléculaire poids ont tendance à être gazeux à température ambiante. Beaucoup sont également liquides et ceux d'un plus grand poids moléculaire sont solides. Dans de nombreux cas, les solides sont des solides amorphes au lieu de cristallins.
Polarité
Tous les hydrocarbures, y compris insaturés, sont des composés apolaires, car l'électronégativité en carbone et l'hydrogène sont très similaires. La seule exception est dans le cas des alkines terminales2 et sp3.
Solubilité
Étant apolaires, les hydrocarbures insaturés sont insolubles dans l'eau et d'autres solvants polaires, mais ils sont très solubles dans les solvants apolaires tels que le tétrachlorure de carbone, le cyclohexan et autres. En fait, beaucoup de ces composés sont, en eux-mêmes, des solvants apolaires.
Il peut vous servir: disposio: structure, propriétés, obtention, utilisationsCe sont des carburants
Une caractéristique de tous les hydrocarbures, y compris insaturés, est qu'ils brûlent en présence d'oxygène pour devenir du dioxyde de carbone et de l'énergie de libération d'eau sous forme de lumière et de chaleur.
Ils peuvent polymériser
Grâce à différentes réactions chimiques, les alcènes et les alkines peuvent se joindre mutuellement pour former des polymères comme dans le cas du polyéthylène et du polypropylène, pour n'en citer que certains. Les hydrocarbures insaturés sont donc le matériau de départ de nombreux plastiques communs.
Réactivité chimique
La réactivité dépend fortement du type de groupe fonctionnel qui a une molécule. Dans le cas des alcènes et des alkines, ceux-ci sont généralement assez réactifs et peuvent subir des réactions d'hydrogénation, d'hydratation, d'hydrohalogénation et d'autres types de réactions d'addition.
D'un autre côté, les composés aromatiques sont généralement assez inertes car ils sont très stables. Les réactions caractéristiques de ces composés sont les réactions de substitution électrophile aromatique.
Nomenclature des hydrocarbures insaturés
Nomenclature des alcènes
Alcènes linéaires
Le nom des alcènes linéaires est construit en plaçant un préfixe qui indique le nombre d'atomes de carbone dans la chaîne, suivi du localisateur de carbone où la double liaison distincte commence par des scripts du reste du nom et terminé avec le suffixe _eno:
Préfixe-localiseur
- Exemple:
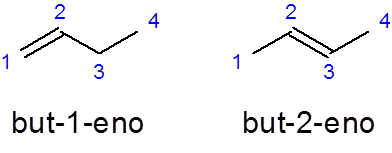
Il But-1-pas C'est le nom du Butene linéaire avec une double liaison dans le premier carbone tandis que le MAIS-2-NINE Il a la double liaison dans le deuxième carbone.
Alcènes ramifiés
Dans le cas d'alcènes ramifiés, la chaîne principale la plus longue contenant les deux carbones à double liaison est d'abord sélectionnée et la priorité à la double liaison est numérotée. Le nom est construit d'abord en plaçant les ramifications dans l'ordre alphabétique précédé de ses localisateurs suivis du nom de la chaîne principale comme indiqué ci-dessus.
- Exemple:
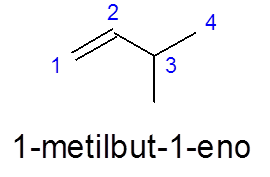
Dans le 3-méthylbut-1 -en, la numérotation est effectuée de gauche à droite pour donner la priorité à la double liaison, au lieu de donner la priorité à la ramification (le groupe méthyle).
Polyènes
Dans le cas d'alcènes polyinsaturés ou polistes, qui contiennent plus d'une double liaison, le plus grand nombre possible de doubles liaisons est sélectionné comme chaîne principale, qu'il existe d'autres chaînes plus longues.
Au nom de la chaîne principale, un localisateur est ajouté pour chaque double liaison et le préfixe di, tri, tetra, etc. Avant la terminaison -eno, pour indiquer le nombre de doubles liens que vous avez.
- Exemple:
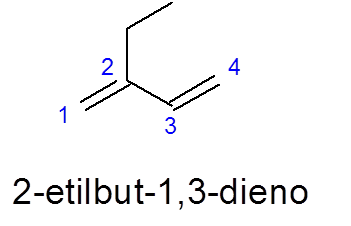
Notez dans ce cas que malgré le fait qu'il y a une chaîne plus longue à 5 carbones, le 4 sur 4 est sélectionné, car il contient les deux doubles liens.
Nomenclature des alquinos
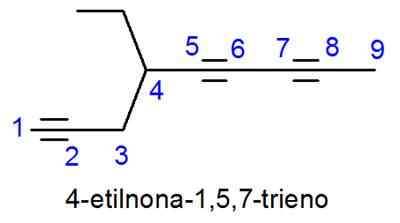
Les alcynes sont nommés très similaires aux alcènes, avec la seule différence dans laquelle le nom se termine par -ino au lieu de -eno. Dans les cas où il y a plus d'un triple lien, les localisateurs de tous sont placés et le préfixe numérique qui indique combien il y a.
- Exemple:
Nomenclature des composés aromatiques
Les hydrocarbures aromatiques sont nommés dérivés de benzène et à la fois la numérotation et la voie de les nommer dépend du nombre de substituants.
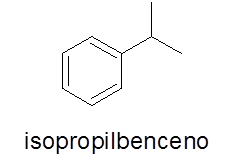
Anneaux aromatiques avec un seul substituant
Dans ce cas, ce n'est pas nécessaire. Le nom se compose du nom de la branche suivi du mot benzène.
- Exemple:
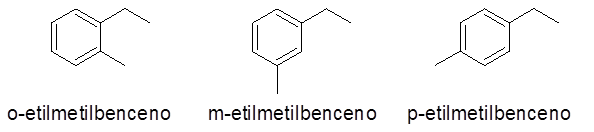
Anneaux aromatiques avec deux substituants
Dans ce cas, 3 nombres ou modèles de remplacement peuvent être donnés (1,2), (1,3) et (1,4). Car il est indifférent à indiquer quel substitut se trouve dans le carbone 1 et lequel dans l'autre, ortho préfixes (O-), méta (m-) et para- (p-), respectivement, pour se référer au même.
- Exemples:
Anneaux aromatiques avec plus de 2 substituants
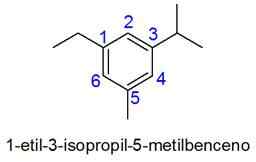
Dans ce cas, la numérotation de la plus petite combinaison de localisateurs est sélectionnée. Si deux nombres sont égaux, la priorité est donnée aux substituants selon l'ordre alphabétique.
- Exemples:
Exemples d'hydrocarbures insaturés
Ensuite, des exemples supplémentaires d'hydrocarbures insaturés sont présentés à ceux déjà mentionnés.
Acétylène (c2H2)
L'acétylène est le nom commun de l'étino, l'alchimine la plus simple. Ce composé a 2 insaturation en raison de son triple lien et est utilisé, entre autres, dans l'équipement d'acier et de soudage.
Cyclohexen (c6Hdix)
6 -carbone Alcène cyclique qui a deux insaturation: l'une en raison du cycle et de l'autre en raison de la double liaison.
Étirement (c8H8)
Ce composé est couramment utilisé dans la préparation des polymères. C'est un alcène aromatique avec 5 insaturation.

