Hybridation chimique

- 3384
- 965
- Prof Noah Collet
Qu'est-ce que l'hybridation chimique?
La Hybridation chimique C'est le "mélange" des orbitales atomiques, dont le concept a été introduit par le chimiste Linus Pauling en 1931 pour couvrir les imperfections de la théorie des liens de Valence (TEV). Quelles imperfections? Ce sont: géométries moléculaires et liens équivalents dans les molécules telles que le méthane (ch4).
Selon le TEV, en méthane, les orbitales atomiques de C Formulaire quatre liens σ avec quatre atomes H. Les orbitales 2p, avec des formes de ∞ (image inférieure) du C sont perpendiculaires les unes aux autres, donc le H doit être retiré les uns des autres à un angle de 90º.

De plus, l'orbitale 2S (sphérique). Cependant, expérimentalement, il a été constaté que les angles du ch4 Ils sont de 109,5 ° et que, en outre, les longueurs des liaisons C-H sont équivalentes.
Pour expliquer cela, une combinaison d'orbitales atomiques d'origine doit être considérée comme former quatre orbitales hybrides dégénérées (d'énergie égale). Ici, l'hybridation chimique entre en jeu. Comment sont les orbitales hybrides? Cela dépend des orbitales atomiques qui les génèrent. Ils présentent également un mélange des caractéristiques électroniques de ces.
Sp3
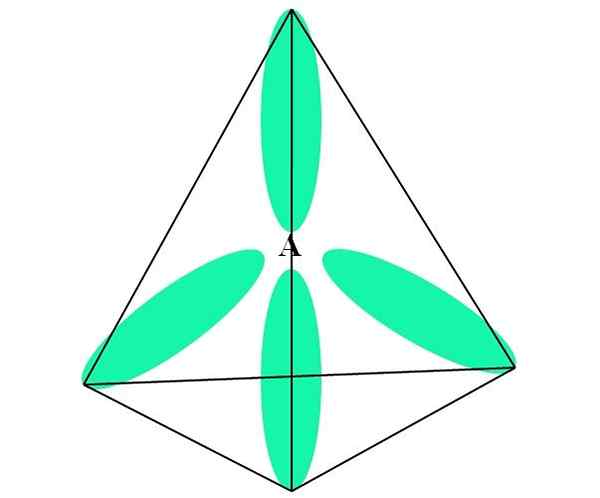
Dans le cas de ch4, L'hybridation C est SP3. De cette approche, la géométrie moléculaire est expliquée avec quatre orbitales SP3 séparés à 109,5 ° et pointant vers les sommets d'un tétraèdre.
Dans l'image supérieure, vous pouvez voir comment les orbitales sp3 (vert) Établir un environnement électronique tétraédrique autour de l'atome (A, qui est c pour ch4).
Peut vous servir: aminesPourquoi 109,5º et pas d'autres angles, afin de "dessiner" une géométrie différente? La raison est due au fait que cet angle minimise les répulsions électroniques des quatre atomes qui sont liés à.
De cette façon, la molécule de Cho4 Il peut être représenté comme un tétraèdre (géométrie moléculaire tétraédrique).
Si, au lieu de H, le C a formé des liens avec d'autres groupes d'atomes, quelle serait alors son hybridation? À condition que le carbone forme quatre liaisons σ (C-A), son hybridation sera SP3.
On peut constamment supposer que dans d'autres composés organiques tels que ch3Oh, CCL4, C (ch3)4, C6H12 (Cyclohexan), etc., Le carbone a une hybridation SP3.
Ceci est essentiel pour esquisser les structures organiques, où les carbones avec des liens simples représentent des points de divergence; c'est-à-dire que la structure ne reste pas dans un seul plan.
Interprétation
Quelle est l'interprétation la plus simple de ces orbitales hybrides sans aborder les aspects mathématiques (fonctions d'onde)? Les orbitales sp3 Ils impliquent qu'ils ont été créés par quatre orbitales: un s et trois p.
Parce que la combinaison de ces orbitales atomiques est censée être idéale, les quatre orbitales SP3 Les résultats sont identiques et occupent différentes orientations dans l'espace (comme dans les orbitales pX, pet Et Pz).
Ce qui précède est applicable pour le reste des hybrides possibles: le nombre des orbitales hybrides qui se forment est le même que celui des orbitales atomiques qui combinent. Par exemple, sp híbridos orbital3d2 Ils sont formés à partir de six orbitales atomiques: une S, trois P et deux D.
Écarts par rapport aux angles de liaison
Selon la théorie de la répulsion des paires électroniques de la couche Valencia (RPECV), une paire d'électrons libres occupe plus de volume qu'un atome lié. Cela fait que les liens s'éloignent, diminuant la tension électronique et détournent les angles du 109,5 °:
Il peut vous servir: Cruise for Crucible: Caractéristiques, fonctions, utilisez des exemples
Par exemple, dans la molécule d'eau, les atomes de H sont liés aux orbitales sp3 (en vert), ainsi que les paires d'électrons non partagées ":" Occupez ces orbitales.
Les répulsions de ces paires d'électrons sont généralement représentées comme "deux ballons avec les yeux" qui, en raison de leur volume, repoussent les deux liaisons σ o-H.
Ainsi, dans l'eau, les angles des liens sont vraiment 105º, au lieu des 109,5 ° attendus pour la géométrie tétraédrique.
Quelle géométrie a alors2SOIT? A une géométrie angulaire. Parce que? Parce que alors que la géométrie électronique est tétraédrique, deux paires d'électrons non partagées le déforment à une géométrie moléculaire angulaire.
Sp2
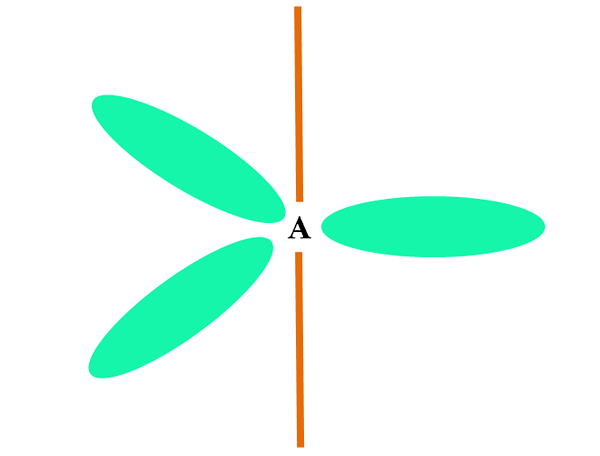
Lorsqu'un atome combine deux orbitales S, elle génère trois orbitales hybrides SP2; Cependant, un P orbital (car il y en a trois) reste inchangé, qui est représenté comme une barre d'orange dans l'image supérieure.
Ici, les trois orbitales sp2 Ils sont verts pour mettre en évidence leur différence de la barre orange: l'orbital p "pur".
Un atome avec hybridation SP2 Il peut être visualisé comme un plancher plat trigonal (le triangle dessiné avec les orbitales SP2 vert), avec ses sommets séparés par des angles de 120 ° et perpendiculaires à une barre.
Et quel rôle le pure pure orbital joue-t-il? Pour former une double liaison (=). Les orbitales sp2 Ils permettent la formation de trois liaisons σ, tandis que la liaison p pure pure orbitale π (un double ou un triple lien implique un ou deux liens π).
Par exemple, pour dessiner le groupe carbonyle et la structure de la molécule de formaldéhyde (H2C = o), il continue comme suit:
Il peut vous servir: Cycopropane (C3H6)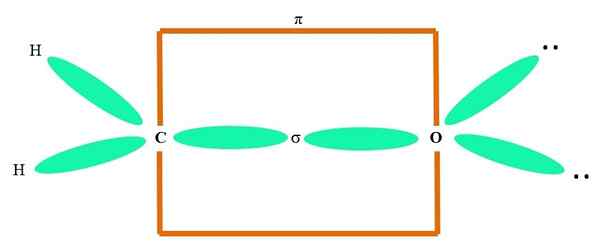
Les orbitales sp2 Le C et le O forment un lien σ, tandis que ses orbitales pures forment une liaison π (le rectangle orange).
On peut remarquer comment les autres groupes électroniques (atomes H et les paires d'électrons non partagés) sont situés dans les autres orbitales SP2, séparé par 120º.
Sp
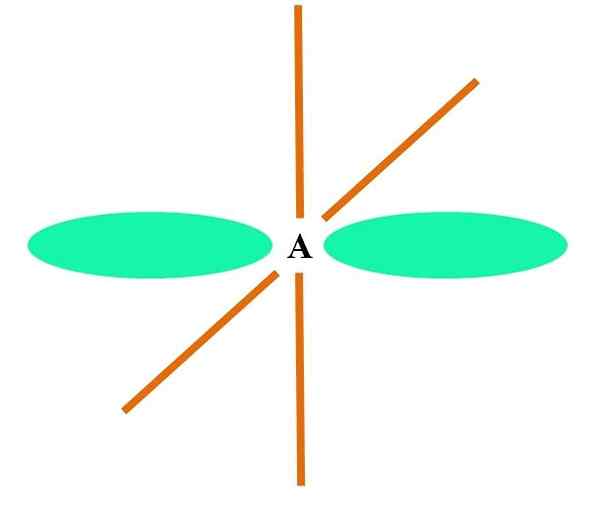
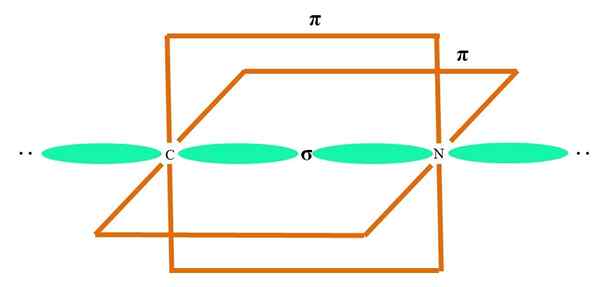
Dans l'image supérieure, un atome est illustré avec une hybridation SP. Ici, une orbitale et une orbitale P. Cependant, deux orbitales orbitales pures sont désormais inchangées, ce qui leur permet de former deux doubles liens ou un triple lien (≡).
En d'autres termes: si dans une structure a c se conforme à ce qui précède (= c = o C≡C), alors son hybridation est sp. Pour d'autres atomes moins illustratifs - comme les métaux de transition - la description des géométries électroniques et moléculaires est compliquée car les orbitales D et même les F sont également considérées.
Les orbitales hybrides sont séparées à un angle de 180º. Pour cette raison, les atomes liés sont disposés en géométrie moléculaire linéaire (B-A-B). Enfin, à l'image inférieure, la structure d'anion du cyanure peut être vue: