Structures de l'hexoquinase, fonctions, formes
- 4200
- 508
- Raphaël Meyer
La Hexoquinase (HK) est l'enzyme qui catalyse la première réaction de la route glycolytique pratiquement dans tous les organismes vivants, à la fois dans les procaryotes et dans les eucaryotes. Il est responsable du transfert d'un groupe phosphoryle vers le glucose, produisant du glucose-6p, bien qu'il puisse également phosphoryler d'autres sucres hexotes (de 6 atomes de carbone).
Cette enzyme est classée dans l'une des deux familles d'enzymes glucose -kinase (enzymes qui transfèrent des groupes phosphoryle vers des substrats tels que le glucose): la famille de l'hexoquinase (HK), dont les membres sont subdivisés en trois groupes différents appelés le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, le groupe HK, Groupe A et groupe B.
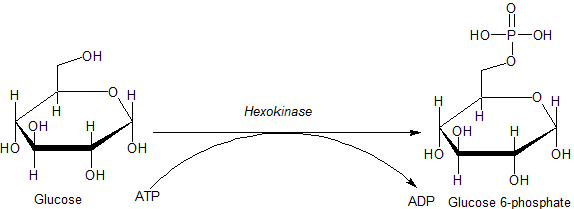
 Réaction catalysée par l'enzyme de l'hexoquinase (Source: JMUN7616 [Domaine public] via Wikimedia Commons)
Réaction catalysée par l'enzyme de l'hexoquinase (Source: JMUN7616 [Domaine public] via Wikimedia Commons) Les enzymes appartenant à la famille HK sont caractérisées par la phosphorylation du glucose au détriment de l'ATP en tant que molécule de donateur de groupe phosphoryle, et les membres de la même différencent les uns des autres principalement par rapport à leur poids moléculaire et leur spécificité de substrat.
The HK Group belongs the enzymes of eukaryotic organisms (ATP: D-hexose 6-fosfotransferases), meanwhile group A is represented by the enzymes of the gram-negative bacteria, cyanobacteria, amithocondried and tripanosomatidal protists, and group B contains the enzymes of gram - Bactéries positives et organismes de créanarqueotas.
Les enzymes des groupes A et B sont également connues sous le nom de glycoquinases (GLCKS), car elles sont capables de phosphorylation exclusivement du glucose, c'est pourquoi ces enzymes sont appelées ATP: D-glucose 6-fosfotransférase.
En tant qu'enzyme glycolytique, l'hexochinase a une grande importance métabolique, car sans elle, cette voie importante ne serait pas possible et les cellules qui dépendent fortement de la consommation de glucides telles que, par exemple, le cerveau et les cellules musculaires de nombreux mammifères, auraient de sérieux impémentes fonctionnels et physiologiques en général.
[TOC]
Structure
Comme nous le verrons plus loin, chez les mammifères et autres vertébrés (ainsi que dans les organismes unicellulaires tels que les levures), il existe différents types d'enzymes de l'hexoquinase. Chez les mammifères, quatre ont été décrits: isoformes I, II, III et IV.
Peut vous servir: alliages ferreux: caractéristiques, types, exemplesLes trois premières isoenzymes ont un poids moléculaire de 100 kDa, mais l'isoenzyme IV a 50 kDa. Ces isoenzymes (en particulier I-III) présentent une forte similitude de séquence entre eux par rapport à leurs extrémités C et N-terminales, ainsi que d'autres membres de la famille de l'hexoquinase.
Le domaine N-terminal de ces enzymes est considéré comme le domaine «régulateur», tandis que l'activité catalytique est réalisée par le domaine C-terminal (HK II des mammifères a des sites actifs dans les deux domaines).
Le domaine N-terminal est lié au domaine C-terminal par une hélice alpha, chacun a environ 50 kDa un poids moléculaire et a une jonction pour le glucose.
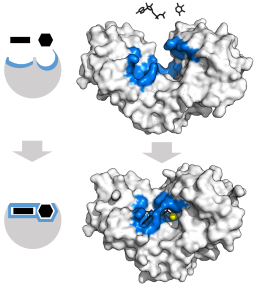 Modèle d'ajustement induit pour l'enzyme de l'hexoquinase (par rapport à ses deux substrats: l'ATP et le glucose) (Source: Thomas Shafee [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] via Wikimedia Commons)
Modèle d'ajustement induit pour l'enzyme de l'hexoquinase (par rapport à ses deux substrats: l'ATP et le glucose) (Source: Thomas Shafee [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] via Wikimedia Commons) La structure tertiaire de ces enzymes est essentiellement composée de feuilles placées en β mélangées à des hélices alpha, dont la proportion varie par rapport à l'enzyme et à l'espèce en question; Le site syndical de l'ATP, l'autre substrat de l'hexoquinase, est généralement composé de cinq feuilles β et de deux hélices alpha.
Les fonctions
La hexoquinase a une fonction transcendantale dans le métabolisme des glucides de la plupart des êtres vivants, car catalyse la première étape de la voie glycolytique, médiant la phosphorylation du glucose à l'intérieur.
Cette première étape de la glycolyse, qui consiste en le transfert d'un groupe phosphoryle de l'ATP (donneur) au glucose, donnant le 6-phosphate et le glucose ADP, est la première des deux étapes d'investissement énergétique sous la forme d'ATP.
De plus, la réaction catalysée par l'hexoquinase est le passage de "l'activation" du glucose pour le traitement ultérieur et représente une étape de "l'engagement", car le glucose ainsi phosphorylé ne peut pas laisser la cellule à travers ses transporteurs conventionnels dans le plasma membranaire.
Peut vous servir: mélanges hétérogènesLe produit de la réaction catalysée par l'hexoquinase, c'est-à-dire le glucose 6-phosphate, est un point de branche, car c'est le premier substrat utilisé sur la route du pentose phosphate et dans la synthèse du glycogène chez de nombreux animaux (et de l'amidon sur les plantes).
Dans les plantes
La fonction de l'hexoquinase dans les plantes n'est pas très différente de celle des animaux ou des micro-organismes, cependant, dans les plantes supérieures, cette enzyme fonctionne également comme un "capteur" de la concentration de sucre.
L'importance de cette fonction dans ces organismes a à voir avec la participation des sucres comme facteurs de régulation dans l'expression des gènes impliqués dans différents processus métaboliques tels que:
- Photosynthèse
- Le cycle de glioxylate
- La respiration
- La dégradation ou la synthèse de l'amidon et du saccharose
- Métabolisme de l'azote
- La défense contre les agents pathogènes
- Régulation du cycle cellulaire
- La réponse de guérison
- Pygmentation
- La sénescence, entre autres.
Cette fonction de l'hexoquinase comme un "capteur" de la quantité de glucose intracellulaire a également été décrite pour les levures et les mammifères.
Formes
Dans la nature, il existe différentes formes d'hexoquinases et cela dépend fondamentalement de l'espèce considérée.
Chez l'homme et d'autres animaux vertébrés, par exemple, l'existence de 4 isoformes différentes de l'enzyme de l'hexoquinase dans le compartiment cytosolique a été démontrée, à laquelle il a été indiqué avec les numéros romains I, II, III et IV.
Les isoenzymes, II et III ont un poids moléculaire de 100 kDa, sont inhibées par leur produit de réaction (6-phosphate glucose) et sont très liés au glucose, c'est-à-dire qu'ils ont une constante de km très faible. Cependant, ces enzymes ont peu de spécificité du substrat, en mesure de phosphoryler d'autres hexosas tels que le fructose et la main.
Peut vous servir: acides: caractéristiques et exemplesL'isoenzyme IV, également connue sous le nom de glycoquinase (GLCK), n'a que 50 kDa un poids moléculaire et, bien qu'il soit peu lié (valeurs élevées de km), a une spécificité élevée par le glucose en tant que substrat et n'est pas soumise aux mécanismes de régulation que l'autre Trois isoenzymes.
La glucocounase (isoenzyme IV de l'hexoquinase de nombreux mammifères) est principalement trouvée dans le foie et aide cet organe dans le "réglage" de sa vitesse de consommation de glucose en réponse aux variations de ce substrat dans le sang circulant en circulation du glucose.
Les trois gènes qui codent pour les hexoquinases I, II et III chez les animaux semblent que III ne réside qu'à l'extrémité C-terminale.
Les références
- Aronoff, s. L., Berkowitz, k., Shreiner, B., & Je veux, L. (2004). Métabolisme et régulation du glucose: au-delà de l'insuline et du glucagon. Diabète spectre, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). Le rôle bifuncion de l'hexokinase dans le métabolisme et la signalisation du glucose. La cellule végétale, quinze(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., & Sheen, J. (1997). Hexokinase quant au capteur de sucre dans les plantes supérieures. La cellule végétale, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, B., & Murata, k. (2005). Hypothèse: structures, évolution et ancêtre des kinases de glucose dans la famille des hexokinases. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, k. ET. (1998). Van Holde. Biochimie.
- Wilson, J. ET. (2003). Isozymes de l'hexokinase des mammifères: structure, localisation subcellulaire et fonction métabolique. Journal of Experimental Biology, 206(12), 2049-2057.

