Structure de glycéraldéhyde, caractéristiques, fonctions
- 3678
- 559
- Raphaël Charles
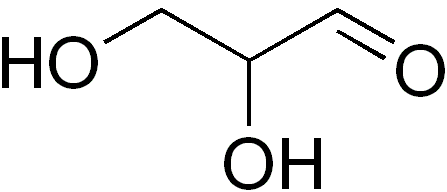
Il glycéraldéhyde C'est le seul monosaccharide à trois carbone, étant à son tour la seule triosa. C'est aussi un aldotriosa car il a un groupe aldéhyde. Le mot glycéraldéhyde provient de la combinaison de glycérine et d'aldéhyde. En effet.
La synthèse chimique de la glycéraldéhyde est réalisée par différentes méthodes, par exemple, en utilisant des enzymes. Le glycéraldéhyde est une molécule plutôt réactive, étant capable de se former scandaleux entre les protéines.
 Source: DRTW à Dutch Wikedia [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Source: DRTW à Dutch Wikedia [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] [TOC]
Structure
Le glycéraldéhyde a un centre asymétrique ou chiral (l'atome de carbone 2, C-2). Il forme deux éantiomères d (dextrogyr) et L (Levógiro), qui tournent le plan de la lumière polarisée dans des directions opposées: la glycéraldéhyde D le tourne vers la droite et la glycéraldéhyde L à gauche.
La rotation optique spécifique du D-glycéraldéhyde, à 25 ºC, est de + 8,7º, et la rotation optique spécifique du D-glycéraldéhyde, à 25 ° C, est de -8,7º. La d-glycéraldéhyde se trouve fréquemment dans la nature, principalement sous forme de glycéraldéhyde 3-phosphate.
La configuration de L-glycéraldéhyde est utilisée comment la référence standard pour les glucides. Dans les molécules biologiques, D-sucre abonde. L'atome de carbone 3 (C-3) du glycéraldéhyde est un groupe d'hydroxyméthylène (-ch2OH).
Caractéristiques
Les cristaux de glycéraldéhyde sont incolores et ont un goût sucré. La formule empirique de ce sucre est C3H6SOIT3 et son poids moléculaire est de 90 g / mol.
En solution aqueuse, le DL-glycéraldéhyde est principalement présent sous forme d'aldéhydrol, qui est une forme hydratée d'aldéhyde. Dl-Glineraldehido cristallin est dimique.
L'analyse des cristaux de glycéraldéhyde par des rayons X a montré qu'il a des anneaux de 1,4 dioxane avec tous les substituants dans l'orientation équatoriale.
En solution aqueuse, le glycéraldéhyde éprouve l'auto-oxydation générant des radicaux libres. Ceci est associé à une consommation rapide d'oxygène.
Il peut vous servir: protocoopérationLa vitesse de consommation d'oxygène diminue lentement en présence de superoxyde dysmutase. Cela suggère qu'il y a une formation de superoxyde pendant l'autooxydation du glycéraldéhyde. Le passage limitant de la glycéraldéhyde autoxide
La synthèse de D-glycéraldéhyde est catalysée par les acides aminés primaires et secondaires, étant favorisée à de faibles valeurs de pH (de 3 à 4).
Les fonctions
En croix entre les protéines
L'interaction protéine-protéine est un mécanisme moléculaire de multiples processus biologiques complexes. Ces interactions peuvent être transitoires, étant l'interaction des protéines à partir d'une voie métabolique ou d'une traduction du signal.
La réticulation chimique constitue une méthode directe pour identifier les interactions protéine-protéine transitoires et stables.
La technique de la ridicule entre les protéines consiste en la formation de liaisons covalentes, pour lesquelles des agents qui ont des groupes réactifs bifuncionaux qui réagissent avec les groupes aminés et les groupes de déchets d'acides aminés sont utilisés.
Plus précisément, les agents réagissent avec les groupes d'amitié primaires (comme l'Epsilon-amino des déchets des lisines) et se croisent à la fois à l'intérieur d'une sous-unité de protéines et entre les sous-unités protéiques.
Il existe une grande variété d'agents disponibles dans le commerce. Bien que le glycéraldéhyde soit un agent croisé, il existe d'autres agents plus populaires, comme le glutaraldéhyde. En effet.
Les autres agents populaires sont des imiderers homobifonctionnels, qui varient dans la longueur du bras de l'espaceur parmi leurs groupes réactifs. Quelques exemples d'imidoesters sont le diméthyl apimidato (DMA), le diméthyl suberimidate (DMS) et le diméthyl pimimimidato (DMP).
Peut vous servir: homopolysaccharides: caractéristiques, structure, fonctions, exemplesEn croix entre les microsphères de gélatine
Les microsphères de gélatine ont le potentiel de servir pour la libération de médicaments contrôlés. En effet, ces microsphères ne sont pas toxiques et que leurs produits sont facilement excrétés. Cependant, la gélatine est un polymère soluble, il doit donc être modifié chimiquement pour servir de système d'expédition de médicament.
D, L-glycéraldéhyde peut être considéré comme un agent de réticulation non toxique (la dose mortelle, DL50 I.p. Chez le rat, c'est 2000 mg / kg). De plus, dans le corps humain, la D-glycéraldéhyde est phosphorylée par la triosa kinase. De cette façon, le glycéraldéhyde à 3 phosphates qui entre dans la glycolyse est formé.
Le traitement des microsphères de gélatine avec d, l-glycéraldéhyde pendant 24 heures produit des microsphères avec un certain nombre d'acides aminés de lysine libre réduits. Par conséquent, la capacité des microsphères à prolonger, par exemple, l'effet de la clockinine hydrocluride, qui est antihypertenseur.
Les microsphères ont été administrées par injection sous-cutanée pour se moquer d'albinas et de rats. Après l'injection, la pression artérielle systolique a diminué pendant deux heures, récupérant par la suite sa valeur basale. Les tissus de la place d'injection ont été analysés et des microfaigres n'ont pas été trouvés, bien que l'inflammation ait été observée.
Dans les réactions prébiotiques
Dans des conditions prébiotiques - comme celles censées avoir la terre primitive - le formaldéhyde aurait pu servir à la synthèse de la glycéraldéhyde, un intermédiaire chimique impliqué dans les processus chimiques qui auraient pu naître la vie à l'origine de la vie.
L'hypothèse précédente est basée sur le fait que la glycolyse et la photosynthèse ont une glycéraldéhyde 3-phosphate comme intermédiaire métabolique.
Un modèle chimique a été proposé qui explique la biosynthèse du glycéraldéhyde du formaldéhyde à travers une voie cyclique. La synthèse du glycéraldéhyde a lieu par addition de formaldéhyde à un triosa (glycéraldéhyde ↔ dihydroxyacétone) pour produire un tétrosa (↔ aldotrosa ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ cet.
Peut vous servir: érythrous: caractéristiques, structure, fonctionsL'ajout de formaldéhyde au glycaldéhyde complète le cycle. La synthèse de deux molécules de triosa de six molécules de formaldéhyde se produit.
En général, la synthèse prébiotique des sucres est censée que la réaction de Formosa est impliquée, dans laquelle le formaldéhyde en présence d'une petite quantité de glycaldéhyde est converti en sucres par des réactions de condensation aldoliques.
Il a été proposé que l'oxydation du sucre prébiotique (glycaldéhyde, triosas, tétrosas) ait produit des polyhydroxyacides qui agissent comme des substances auto-ouvertes.
La conversion de la glycéraldéhyde en acide lactique et en acide glycérique, en oxyde dépendant de l'hydroxyde de fer, pointe vers les oligoéséres de ces hydroxyacides a eu lieu à la surface de ce matériau.
Les références
- Breslow, R., Ramalingam, V., Appaeee, C. 2013. Catalyse de la synthèse de glycéraldéhyde par des acides aminés primaires ou secondaires dans des conditions prébiotiques une fonction du pH. Origine biosphera d'évolution de la vie. Doi 10.1007 / S11084-013-9347-0.
- Carey, F. POUR., Giuliano, R. M. 2016. Chimie organique. McGraw-Hill, New York.
- Robyt, J.F. 1998. Essentiels de la chimie des glucides. Springer, New York.
- Thornalley, P., Wolff, s., Crabbe, J., Stern, un. 1984. L'autoxydation de la glycéraldéhyde et d'autres monosaccharides simples sous catalyse physiologique par tampon. Biochimica et Biophysica Acta, 797, 276-287.
- Vandelli, m.POUR., Rivas, f., Guerre, P., Forni, f., Arletti, R. 2001. Microsphères gélatine réticulées avec D, L-glycéraldéhyde comme un système de livraison potentiel de Drarug: préparation, caractérisation, études in vitro et in vivo. International Journal of Pharmaceutics, 215, 175-184.
- Weber, un.L. 1987. Le modèle de trose: glycéraldéhyde comme source d'énergie et de monomères pour les réactions de condensation prébiotique. Origines de la vie, 17, 107-19.
- « Caractéristiques érythratiques, structure, fonctions
- Caractéristiques de la sérine, fonctions, métabolisme, nourriture »

