Caractéristiques de la sérine, fonctions, métabolisme, nourriture
- 796
- 201
- Eva Henry
La Sérine C'est l'un des 22 acides aminés de base, bien qu'il ne soit pas classé comme un acide aminé essentiel pour l'homme et d'autres animaux, car il est synthétisé par le corps humain.
Selon la nomenclature à trois lettres, la sérine est décrite dans la littérature comme étant (s dans le code de lettre unique). Cet acide aminé participe à un grand nombre de routes métaboliques et a des caractéristiques polaires, mais n'a pas de charge sur le pH neutre.
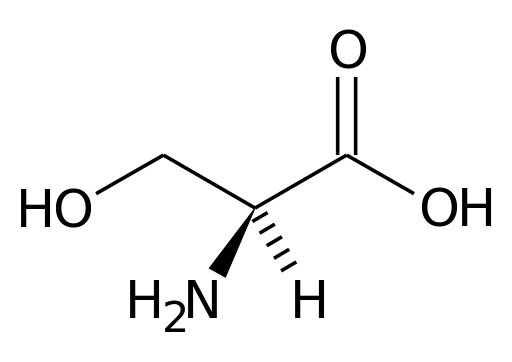
 Représentation de la série de l'acide aminé de sérine (Source: Pagezero.Wikipedia [domaine public] via Wikimedia Commons)
Représentation de la série de l'acide aminé de sérine (Source: Pagezero.Wikipedia [domaine public] via Wikimedia Commons) De nombreuses enzymes importantes pour les cellules ont beaucoup.
La sérine, parmi bon nombre de ses fonctions, participe comme un précurseur et une molécule d'échafaudage dans la biosynthèse d'autres acides aminés tels que la glycine et la cystéine et fait partie de la structure des sphingolipides présents dans les membranes cellulaires des membranes cellulaires.
Le taux de synthèse de la sérine varie dans chaque organe et, en outre, il change en fonction du stade de développement dans lequel l'individu est.
Les scientifiques ont proposé que les concentrations de L-sérine dans les tissus cérébraux augmentent avec l'âge, puisque la perméabilité de la barrière des cellules sanguines diminue dans le cerveau de l'adulte, pouvant provoquer de graves troubles cérébraux.
Il est connu que la L-Serine est vitale pour la biosynthèse des neurotransmetteurs, des phospholipides et d'autres macromolécules complexes, car il fournit les précurseurs de ces multiples voies métaboliques.
Diverses études ont montré que l'approvisionnement en suppléments ou concentrés de L-sérine à certains types de patients améliore l'homéostasie du glucose, la fonction mitochondriale et réduit la mort neuronale.
[TOC]
Caractéristiques et structure
Tous les acides aminés ont comme structure de base un groupe carboxyle et un groupe amino attaché au même atome de carbone; Cependant, ceux-ci diffèrent les uns des autres par leurs chaînes latérales, appelées groupes R, qui peuvent varier dans leur taille, leur structure et même dans leur charge électrique
La sérine contient trois atomes de carbone: un carbone central uni, d'une part, dans un groupe carboxyle (COOH) et d'autre part, un groupe amino (NH3 +). Les deux autres liaisons en carbone central sont occupées par un atome d'hydrogène et un groupe CH2OH (groupe R), caractéristique de la sérine.
Le carbone central auquel les groupes amino et carboxyle des acides aminés sont connus sous le nom de carbone α. Les autres atomes de carbone des groupes R sont désignés avec les lettres de l'alphabet grec.
Dans le cas de la sérine, par exemple, le seul atome de carbone de son groupe R, qui est lié au groupe OH, est connu sous le nom de carbone γ.
Peut vous servir: phosphatidilsérine: structure, synthèse, fonctions, emplacementClassification
La sérine est classée dans le groupe d'acides aminés polaires sans charge. Les membres de ce groupe sont des acides aminés très solubles dans l'eau, c'est-à-dire ce sont des composés hydrophiles. Dans la sérine et la treonine, l'hydrophilie est due à sa capacité à former des ponts d'hydrogène avec de l'eau à travers ses groupes hydroxyles (OH).
Dans le groupe d'acides aminés polaires sans charge, la cystéine, l'asparagine et la glutamine sont également regroupées. Tous ces éléments ont un groupe polaire dans leur chaîne R, cependant, ce groupe n'est pas ionisable et le pH proche de la neutralité annule ses charges produisant un composé sous la forme de "Zwitterion".
Stéréochimie
L'asymétrie générale des acides aminés rend la stéréochimie de ces composés d'importance vitale dans les routes métaboliques dans lesquelles ils participent. Dans le cas de la sérine, cela peut être trouvé comme d-l-serine, étant ce dernier synthétisé exclusivement par les cellules du système nerveux appelées astrocytes.
Les carbones α des acides aminés sont des carbones chiraux, car ils ont quatre substituants unis différents, ce qui génère qu'il existe au moins deux stéréoisomères distinctibles pour chaque acide aminé.
Un stéréoisomère est une image miroir d'une molécule, c'est-à-dire que vous ne pouvez pas chevaucher l'un sur l'autre. Les solutions de ces acides aminés tournent le plan lumineux polarisé dans des directions opposées dans des directions opposées.
La l-sérine synthétisée dans les cellules du système nerveux sert de substrat pour synthétiser la glycine ou la d-sérine. Le D-Serin est l'un des éléments les plus importants pour l'échange de vésicules entre les neurones, donc certains auteurs proposent que les deux isoformes de sérine sont, en réalité, des acides aminés essentiels pour les neurones pour les neurones.
Les fonctions
Le groupe OH de la sérine dans sa chaîne R R en fait un bon nucléophile, il est donc essentiel à l'activité de nombreuses enzymes avec de la sérine dans ses sites actifs. La sérine est l'un des substrats nécessaires à la synthèse des nucléotides NADPH et glutathionique.
La série L est indispensable pour le développement et le bon fonctionnement du système nerveux central. Des études ont montré que l'approvisionnement exogène en l-sérine à faible doses aux neurones d'hippocampe et aux cellules Purkinje In vitro, Améliore votre survie.
Plusieurs études sur les cellules cancéreuses et les lymphocytes ont montré que des unités de carbone dépendantes de la sérine sont nécessaires pour la production de nucléotides excessive, ainsi que la prolifération ultérieure des cellules cancéreuses.
Peut vous servir: microbiote: composition, fonctions et où est-ceLa sélénocystéine fait partie des 22 acides aminés de base et n'est obtenu que comme dérivé de la sérine. Cet acide aminé n'a été observé que dans certaines protéines, contient du sélénium au lieu de soufre attaché à la cystéine et est synthétisé sur la base d'une sérine stérifiée.
Biosynthèse
La sérine est un acide aminé non essentiel, car il est synthétisé par le corps humain. Cependant, cela peut être assimilé à partir du régime alimentaire de différentes sources telles que les protéines et les phospholipides, principalement.
La sérine est synthétisée sous sa forme par la conversion d'une molécule de glycine, une réaction médiée par une enzyme hydroxyméthyl-transférase.
Il est connu que le principal lieu de synthèse de la l-sérine est dans les astrocytes et non dans les neurones. Ce sont ces cellules, la synthèse se produit par une voie de phosphorylation dans laquelle le 3-phosphoglycérate participe, un intermédiaire glycolytique.
Trois enzymes agissent sur cette voie: la 3-phosphoglycérate déshydrogénase, la phosphosérine-transférase et la phosphosérine-phosphatase.
Les autres organes importants en ce qui concerne la synthèse de la sérine est le foie, les reins, les testicules et la rate. Les enzymes qui synthétisent la sérine.
L'une des premières voies de synthèse de la sérine connue était la voie catabolique impliquée dans la gluconéogenèse, où la l-sérine est obtenue comme métabolite secondaire. Cependant, la contribution de cette voie vers la production de sérine corporelle est faible.
Métabolisme
Il est actuellement connu que la sérine peut être obtenue à partir du métabolisme des glucides dans le foie, où l'acide d glycérique, l'acide 3-phosphoglycérique et l'acide 3-phosphohydroxipirúvic sont produits. Grâce à un processus de transamination entre l'acide pyruvique 3-hydroxi et l'alanine est produit de la sérine.
Des expériences avec des rats marquant radioactivement le carbone 4 de glucose, ont conclu que ce carbone est efficacement incorporé dans les squelettes de carbone de la sérine, ce qui suggère que ledit acide aminé a un précurseur de trois carbones probablement du pyruvate.
Dans les bactéries, l'enzyme de L-sérine-désaminase est l'enzyme principale en charge de la métabolisation de la sérine: il convertit la L-sérine en pyruvate. Il est connu que cette enzyme est présente et active dans les cultures de ET. coli Accorder dans des médias minimaux avec du glucose.
On ne sait pas avec certitude quelle est la fonction réelle de la L-sérine-désaminase dans ces micro-organismes, car son expression est induite par des effecteurs mutationnels qui endommagent l'ADN par le rayonnement ultraviolet, en raison de la présence de Nalidíxico, de la mythomicine et d'autres, de la mythomicine et D'autres, il s'ensuit donc qu'il doit avoir d'importantes implications physiologiques.
Peut vous servir: Dryopithecus: découverte, caractéristiques, crâne, nourritureFoods riche en sérine
Tous les aliments aux concentrations riches en protéines sont riches en sérine, principalement des œufs, des viandes et du poisson. Cependant, il s'agit d'un acide aminé non essentiel, il n'est donc pas strictement nécessaire de l'ingérer, compte tenu du fait que le corps est capable de le synthétiser par lui-même.
Certaines personnes souffrent d'un trouble inhabituel, car ils ont un phénotype de carence en ce qui concerne les mécanismes de synthèse de la sérine et de la glycine, ils doivent donc ingérer des compléments alimentaires concentrés pour les deux acides aminés.
De plus, des marques commerciales spécialisées dans la vente de suppléments de vitamines (Lamberts, Now Sport et Holomega) offrent des concentrés de phosphatidylsérine et de L-Serine pour augmenter la production de masse musculaire chez les athlètes et les haltérophiles à haute compétition.
Maladies connexes
Le dysfonctionnement des enzymes impliquées dans la biosynthèse de la sérine peut provoquer de graves pathologies. En diminuant la concentration de sérine dans le plasma sanguin et le liquide céphalo-rachidien, il peut provoquer l'hypertonie, le retard psychomotor, la microcéphalie, l'épilepsie et les troubles complexes du système nerveux central.
Il a actuellement été découvert que la carence en sérine est impliquée dans le développement du diabète sucré, car la l-sérine est nécessaire pour la synthèse de l'insuline et celle de ses récepteurs.
Les bébés qui présentent des défauts dans la biosynthèse de la sérine sont neurologiquement anormaux à la naissance, ont des retards dans la croissance intra-utérine, la microcéphalie congénitale, les cataractes, les convulsions et un grave retard dans le développement neurologique.
Les références
- Elsila, J. ET., Dworkin, J. P., Bernstein, m. P., Martin, M. P., & Sandford, s. POUR. (2007). Mécanismes de formation d'acides aminés dans les analogues de la glace interstellaire. The Astrophysical Journal, 660 (1), 911.
- Ichord, R. N., & Bearden, D. R. (2017). Encéphalopathies métaboliques périnatales. Dans la neurologie pédiatrique de Swaiman (PP. 171-177). Elsevier.
- Mothet, J. P., Parent, un. T., Wolosker, H., Brady, R. SOIT., Linden, D. J., Ferris, C. D.,… & Snyder, S. H. (2000). La D-Serine est un ligand endogène pour le site de glycine du récepteur N-méthyl-D-Asartate. Actes de la National Academy of Sciences, 97 (9), 4926-4931
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Rodríguez, un. ET., Ducker, G. S., Billingham, L. K., Martinez, C. POUR., Mainolfi, n., Suri, V.,… & Chandel, n. S. (2019). Le métabolisme de la sérine soutient la production de macrophages IL-1β. Métabolisme cellulaire, 29 (4), 1003-1011.
- Tabatabaie, L., KLOmp, L. W., Berger, R., & Koning, t. J. (2010). L-Serine Synthesis dans le système nerveux central: une revue sur les troubles de la carence en sérine. Génétique moléculaire et métabolisme, 99 (3), 256-262.
- « Structure de glycéraldéhyde, caractéristiques, fonctions
- Historique du zinc, propriétés, structure, risques, utilisations »

