Concept de géométrie moléculaire, types et exemples
- 4542
- 159
- Eva Henry
La Géométrie moléculaire soit structure moleculaire C'est la distribution spatiale des atomes autour d'un atome central. Les atomes représentent des régions où il y a une densité électronique élevée et sont donc considérées comme des groupes électroniques, indépendamment des liens qui se forment (simple, double ou triple).
La géométrie moléculaire d'un élément peut caractériser certaines de ses propriétés physiques ou chimiques (point d'ébullition, viscosité, densité, etc.). Par exemple, la structure moléculaire de l'eau détermine sa solubilité.
 Source: Gabriel Bolívar
Source: Gabriel Bolívar Ce concept est né de la combinaison et des données expérimentales de deux théories: celle de la liaison Valence (TEV) et de la répulsion des paires électroniques de la couche de Valence (RPECV). Tandis que le premier définit les liens et leurs angles, le second établit la géométrie et, par conséquent, la structure moléculaire.
Quelles formes géométriques sont capables d'adopter des molécules? Les deux théories précédentes contribuent les réponses. Selon le RPECV, les atomes et les paires d'électrons libres doivent être disposés dans l'espace de telle manière que la répulsion électrostatique entre eux diminue au maximum.
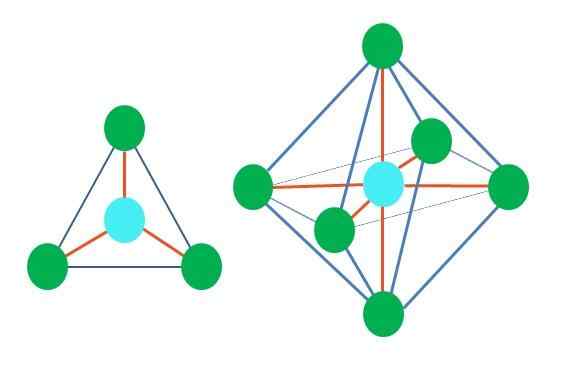
Ainsi, les formes géométriques ne sont pas arbitraires, mais recherchez la conception la plus stable. Par exemple, dans l'image supérieure, un triangle peut être vu à gauche, et à droite un octaèdre. Les points verts représentent les atomes et les rayures orange Les liens.
Dans le triangle, les trois points verts sont orientés dans une séparation de 120º. Cet angle, qui est égal à celui de la liaison, permet aux atomes de se repousser comme possible. Par conséquent, une molécule avec un atome central attaché à trois autres adoptera une géométrie trigonale plate.
Cependant, le RPECV prédit qu'une paire d'électrons libres dans l'atome central déformer la géométrie. Dans le cas du plan trigonal, ce couple va pousser les trois points verts, résultant en une géométrie pyramide trigonale.
La même chose peut également se produire avec l'octaèdre de l'image. Tous les atomes sont séparés de la manière la plus stable possible.
[TOC]
Comment savoir à l'avance la géométrie moléculaire d'un atome x?
Pour cela, il est également nécessaire de considérer les électrons libres comme des groupes électroniques. Ceux-ci, ainsi que les atomes, définiront ce que l'on appelle le Géométrie électronique, qui est un compagnon inséparable de la géométrie moléculaire.
De la géométrie électronique, et après avoir détecté les paires d'électrons libres par la structure de Lewis, il peut être établi quelle géométrie moléculaire sera. La somme de toutes les géométries moléculaires fournira un croquis de la structure globale.
Types de géométrie moléculaire
Comme on peut le voir dans l'image principale, la géométrie moléculaire dépend du nombre d'atomes entourés de l'atome central. Cependant, si quelques électrons sont présents sans partage, il modifiera la géométrie car elle occupe beaucoup de volume. Par conséquent, il exerce un effet stérique.
Selon cela, la géométrie peut présenter une série de formes caractéristiques pour de nombreuses molécules. Et c'est là que surviennent les différents types de géométrie moléculaire ou de structure moléculaire.
Quand la géométrie est-elle égale à la structure? Les deux en désignent uniquement dans les cas où la structure n'a pas plus d'un type de géométrie; Sinon, tous les types présents doivent être pris en compte et donner à la structure un nom global (linéaire, ramifié, globulaire, plat, etc.).
Peut vous servir: hydraceLes géométries sont particulièrement utiles pour expliquer la structure d'un solide de ses unités structurelles.
Linéaire
Toutes les liaisons covalentes sont directionnelles, donc le lien A-B est linéaire. Mais la molécule AB sera-t-elle linéaire2? Si c'est le cas, la géométrie est simplement représentée comme: B-A-B. Les deux atomes B sont séparés par un angle de 180 °, et selon le TEV, un incontournable des orbitales SP hybrides.
Angulaire
 Source: Gabriel Bolívar
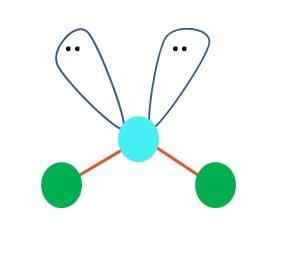
Source: Gabriel Bolívar Une géométrie linéaire pour la molécule AB peut être supposée en premier lieu2; Cependant, il est essentiel de dessiner la structure de Lewis avant de parvenir à une conclusion. Dessiné la structure de Lewis, vous pouvez identifier le nombre de paires électroniques rares (:) sur l'atome d'un.
Quand il en est ainsi, sur les paires d'électrons, les deux atomes de B en bas, changeant leurs angles. En conséquence, la molécule linéaire B-A-B finit par devenir un V, un boomerang ou une géométrie angulaire (image supérieure)
La molécule d'eau, H-O-H, est l'exemple idéal pour ce type de géométrie. Dans l'atome d'oxygène, il y a deux paires d'électrons sans partage qui sont orientées à un angle approximatif de 109º.
Pourquoi cet angle? Parce que la géométrie électronique est tétraédrique, qui a quatre sommets: deux pour les atomes H et deux pour les électrons. Dans l'image supérieure, notez que les points verts et les deux "lobes avec les yeux" dessinent un tétraèdre avec le point bleuâtre en son centre.
Si la OR n'avait pas d'électrons libres, l'eau formerait une molécule linéaire, sa polarité diminuerait et les océans, les mers, les lacs, etc., Ils n'existeraient probablement pas comme ils se connaissent.
Tétraédrique
 Source: Gabriel Bolívar
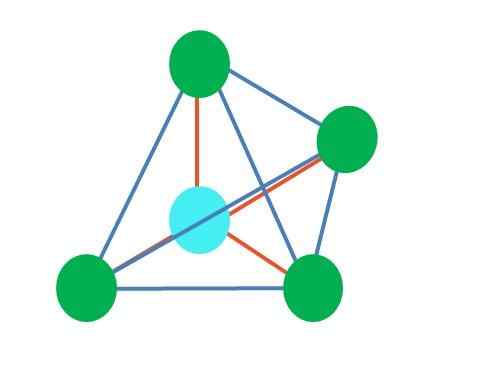
Source: Gabriel Bolívar L'image supérieure représente la géométrie tétraédrique. Pour la molécule d'eau, sa géométrie électronique est tétraédrique, mais en éliminant les paires sans électrons, il peut être noté qu'elle est transformée en géométrie angulaire. Ceci est également simplement observé en éliminant deux points verts; Les deux autres attireront le V avec le point bleu.
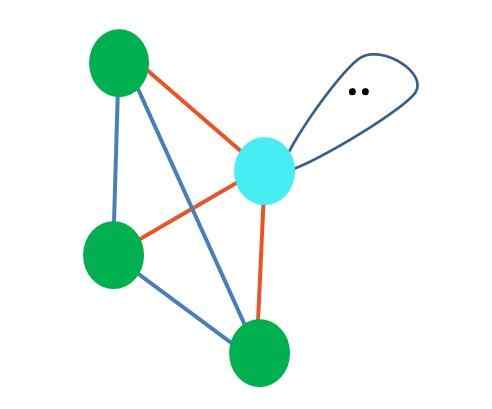
Et si au lieu de deux paires d'électrons libres, il n'y en avait qu'un? Ensuite, il y aurait un plan trigonal (image principale). Cependant, en éliminant un groupe électronique, l'effet stérique produit par la paire d'électrons libres n'est pas évité. Par conséquent, il déforme le plan trigonal vers une pyramide de base triangulaire:
 Source: Gabriel Bolívar
Source: Gabriel Bolívar Bien que la géométrie moléculaire trigonale et la pyramide tétraédrique soient différentes, la géométrie électronique est la même: tétraédrique. Ainsi, la pyramide trigonale ne compte pas comme la géométrie électronique?
La réponse est non, car c'est le produit de la distorsion causée par le "lobe avec les yeux" et son effet stérique, et ladite géométrie ne prend pas en compte les distorsions ultérieures.
Pour cette raison, il est toujours important de déterminer la première géométrie électronique à l'aide de structures Lewis avant de définir la géométrie moléculaire. La molécule d'ammoniac, NH3, Il s'agit d'un exemple de pyramide trigonal de géométrie moléculaire, mais avec une géométrie électronique tétraédrique.
Bipiramide trigonal
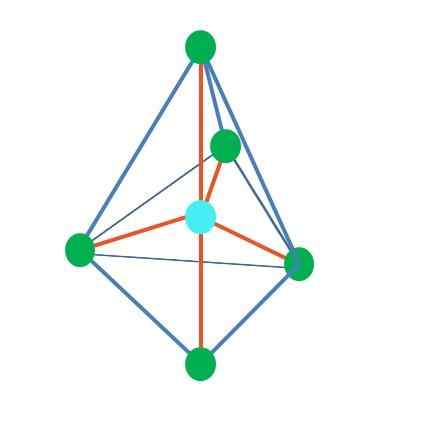 Source: Gabriel Bolívar
Source: Gabriel Bolívar Jusqu'à présent, à l'exception de la géométrie linéaire, dans la pyramide tétraédrique, angulaire et trigonal, leurs atomes centraux ont une hybridation SP SP3, Selon le TEV. Cela signifie que si ses angles de liaison étaient déterminés expérimentalement, ils devraient être d'environ 109º.
Il peut vous servir: chimie appliquée: objet d'étude, branches, importance, exemplesDe la géométrie dipharmide trigonale, il y a cinq groupes électroniques autour de l'atome central. Dans l'image supérieure, vous pouvez voir avec les cinq points verts; trois dans la base triangulaire, et deux dans des positions axiales, qui sont les sommets supérieurs et inférieurs de la pyramide.
Quelle hybridation a alors le point bleu? Il a besoin de cinq orbitales hybrides pour former des obligations simples (orange). Cela y parvient à travers les cinq orbitales sp3D (produit du mélange d'une orbite s, trois p et un d).
Lorsque l'on considère cinq groupes électroniques, la géométrie est déjà exposée, mais ayant des paires d'électrons sans partage, elle souffre à nouveau de distorsions qui génèrent d'autres géométries. De même, la question suivante se pose: ces paires peuvent occuper n'importe quelle position de la pyramide? Ce sont: l'axial ou l'équatorial.
Positions axiales et équatoriales
Les points verts qui composent la base triangulaire sont en position équatoriale, tandis que les deux aux extrémités supérieures et inférieures, en positions axiales. Où préférentiellement la paire d'électrons sera située sans partager? Dans cette position qui diminue à la répulsion électrostatique maximale et à l'effet stérique.
En position axiale, la paire d'électrons rendrait la «pression» perpendiculaire (90º) sur la base triangulaire, tandis que s'il était en position équatoriale, les groupes électroniques restants de la base seraient séparés à 120 ° et appuyaient sur les deux extrémités à 90º (au lieu de trois, comme avec la base).
Par conséquent, l'atome central cherchera à guider ses pairs sans électrons dans des positions équatoriales pour générer des géométries moléculaires plus stables.
Osciller et forme de t
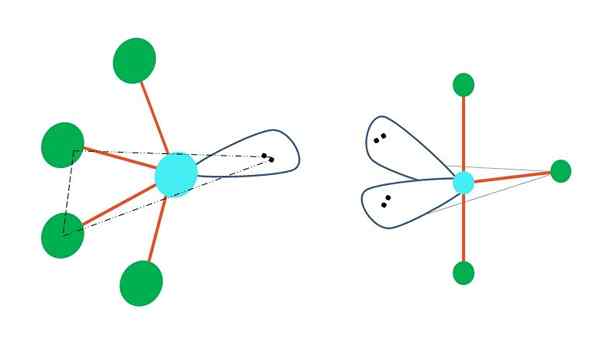 Source: Gabriel Bolívar
Source: Gabriel Bolívar Si un ou plusieurs de ses atomes exempts d'électrons sont remplacés en géométrie bipirramide trigonale, différentes géométries moléculaires auraient également.
À gauche de l'image supérieure, la géométrie se transforme en forme oscillante. Dans ce document, le couple sans électrons pousse le reste des quatre atomes vers la même direction, pliant leurs liens vers la gauche. Notez que ce couple et deux des atomes se trouvent dans le même plan triangulaire du bipiramide d'origine.
Et à droite de l'image, la géométrie en forme de t. Cette géométrie moléculaire est le résultat du remplacement de deux atomes par deux paires d'électrons, ce qui a donné que les trois atomes restants s'alignent dans le même plan qui dessine exactement une lettre t.
Donc, pour une molécule de type AB5, Cela adopte la géométrie bipyramide trigonale. Cependant, AB4, Avec la même géométrie électronique, il adoptera la géométrie oscillante; et ab3, Géométrie en forme de T. Dans chacun d'eux aura (généralement) une hybridation SP3d.
Pour déterminer la géométrie moléculaire, il est nécessaire de dessiner la structure de Lewis et donc sa géométrie électronique. S'il s'agit d'un bipiramide trigonal, les paires sans électrons seront alors jetées, mais pas leurs effets stériques sur le reste des atomes. Ainsi, il peut être parfaitement discerné entre les trois géométries moléculaires possibles.
Octaédrique
À droite de l'image principale, la géométrie moléculaire octaédrique est représentée. Ce type de géométrie correspond aux composés AB6. UN B4 Ils forment la base carrée, tandis que les deux restants se positionnent dans des positions axiales. Ainsi, plusieurs triangles équilatéraux sont formés, qui sont les visages de l'octaèdre.
Peut vous servir: énergie d'activationIci, encore une fois, il peut y avoir (comme dans toutes les géométries électroniques) des paires d'électrons libres, et donc dériver de ce fait d'autres géométries moléculaires. Par exemple, ab5 Avec la géométrie électronique octroniste, il se compose d'une pyramide avec une base carrée et AB4 d'un plan carré:
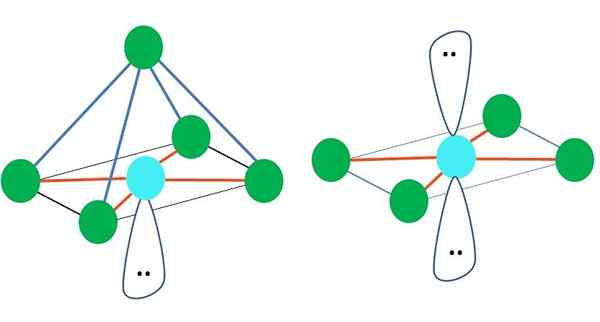 Source: Gabriel Bolívar
Source: Gabriel Bolívar Dans le cas de la géométrie électronique octroniste, ces deux géométries moléculaires sont les plus stables en termes de répulsion électrostatique. Dans la géométrie plate carrée, les deux paires d'électrons sont séparées à 180 °.
Qu'est-ce que l'hybridation de l'atome dans ces géométries (ou structures, si c'est la seule)? Encore une fois, le TEV établit que c'est SP3d2, Six orbitales hybrides, qui vous permet de guider les groupes électroniques dans les sommets d'un octaèdre.
Autres géométries moléculaires
Modification des bases des pyramides mentionnées jusqu'à présent, des géométries moléculaires plus complexes peuvent être obtenues. Par exemple, le bipiramide pentagonal est basé sur un pentagone et les composés qui forment ont une formule générale AB7.
Comme les autres géométries moléculaires, le remplacement des atomes B par des paires sans électrons faussera la géométrie à d'autres formes.
Aussi, composés AB8 Ils peuvent adopter des géométries telles que l'antiprisme carré. Certaines géométries peuvent devenir très compliquées, en particulier pour les formules AB7 Désormais12).
Exemples de géométrie moléculaire
Une série de composés sera mentionnée ci-dessous pour chacune des principales géométries moléculaires. En tant qu'exercice, les structures Lewis pourraient être dessinées pour tous les exemples et certifier si, étant donné la géométrie électronique, les géométries moléculaires sont obtenues car elles sont énumérées ci-dessous.
Géométrie linéaire
-Éthylène, h2C≡CH2
-Chlorure de béryllium, Becl2 (Cl-Be-Cl)
-Dioxyde de carbone, CO2 (O = c = o)
-Azote, n2 (N≡n)
-Dibromure de mercure, hgbr2 (BR-HG-BR)
-Triyoduro anion, je3- (I-i-i)
-Acide madehydrique, HCN (H-N≡C)
Ses angles doivent être 180 ° et ont donc une hybridation SP.
Géométrie angulaire
-L'eau
-Dioxyde de soufre, donc2
-Dioxyde d'azote, non2
-Ozone, ou3
-Amiduro Anion, NH2-
Trigonal plat
-Trifluoride de brome, bf3
-Trichlorure d'aluminium, alcl3
-Anion nitrate, non3-
-Carbonate Anion, CO32-
Tétraédrique
-Gas Metano, ch4
-Tétrachlorure de carbone, CCL4
-Cation ammonium, NH4+
-Anion sulfate, donc42-
Pyramide trigonale
-Ammoniac, NH3
-Cation hydronio, h3SOIT+
Bipiramide trigonal
-Phosphore pentafluoruro, pf5
-Pentachlorure d'antimoine, SBF5
Oscillant
Tétrafluorure de soufre, SF4
Forme de t
-Trichlorure d'iode, ICL3
-Trifluoride de chlore, CLF3 (Les deux composés sont connus sous le nom d'interhalogènes)
Octaédrique
-Hexafluoruro de soufre, SF6
-Sélénium hexafluoruro, SEF6
-Hexaflorophosphate, pf6-
Pour culminer, la géométrie moléculaire est celle qui explique les observations des propriétés chimiques ou physiques de la question. Cependant, il est orienté selon la géométrie électronique, de sorte que ce dernier doit toujours être déterminé avant le premier.
Les références
- Whitten, Davis, Peck & Stanley. Chimie. (8e Ed.). Cengage Learning, p 194-198.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition., p. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Géométrie moléculaire et théorie VSEPR. Récupéré de: NYU.Édu
- Virtual Chembook, Charles et. Ophardt. (2003). Introduction à la géométrie moléculaire. Récupéré de: chimie.chèque.Édu
- CHIMISTER BOOLISTexts. (8 septembre 2016). Géométrie des molécules. Récupéré de: Chem.Bibliothèque.org
- « Modèles d'enseignement pédagogiques (traditionnels et actuels)
- Les 25 jeux traditionnels les plus populaires »

