Force de cohésion
- 1528
- 210
- Noa Da silva
Quelles sont les forces de cohésion?
Le forces de cohésion Ce sont les forces d'attraction intermoléculaires qui gardent certaines molécules avec d'autres. Selon l'intensité des forces de cohésion, une substance est à l'état solide, liquide ou gazeux. La valeur des forces de cohésion est une propriété intrinsèque de chaque substance.
Cette propriété est liée à la forme et à la structure des molécules de chaque substance. Une caractéristique importante des forces de cohésion est qu'elles diminuent rapidement lorsque la distance augmente. Ensuite, ils sont appelés forces de cohésion aux forces d'attraction qui se produisent entre les molécules de la même substance.
Le Forces de répulsion Ce sont ceux qui résultent de l'énergie cinétique (énergie due au mouvement) des particules. Cette énergie fait que les molécules sont constamment en mouvement. L'intensité de ce mouvement est directement proportionnelle à la température à laquelle la substance est.
Pour provoquer le changement de statut d'une substance, il est nécessaire d'élever sa température au moyen d'une transmission de chaleur. Cela fait augmenter les forces de répulsion de la substance, ce qui, le cas échéant, peut finir par supposer le changement d'État.
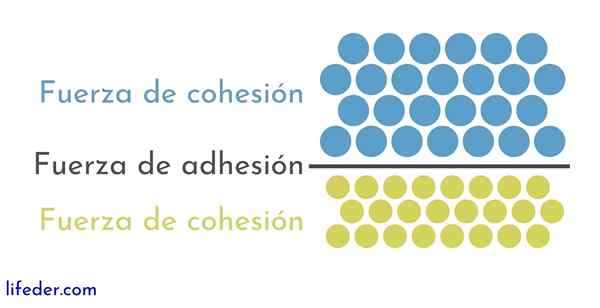
D'un autre côté, il est important et nécessaire de distinguer cohésion et adhésion:
- La cohésion est due aux forces d'attraction entre les particules adjacentes de la même substance.
- L'adhésion est le résultat de l'interaction qui se produit entre les surfaces de différentes substances ou corps.
Ces deux forces semblent liées à plusieurs phénomènes physiques qui affectent les liquides, il est donc important une bonne compréhension de l'une et de l'autre.
Il peut vous servir: Vy Canis Majalis: découverte, caractéristiques, structure, formation et évolutionForces de cohésion dans les solides, les liquides et les gaz
 Atomes dans les trois principaux états de matière
Atomes dans les trois principaux états de matière En solides
En général, dans les solides, les forces de cohésion sont très élevées et sont données intensément dans les trois directions de l'espace.
De cette façon, si une force externe est appliquée à un corps solide, les petits déplacements des molécules se produisent les uns avec les autres.
De plus, lorsque la force externe disparaît, les forces de cohésion sont suffisamment fortes pour revenir aux molécules dans leur position d'origine, récupérant la position avant l'application de la force.
Dans les liquides
Au contraire, dans les liquides, les forces de cohésion ne sont élevées que dans deux des directions spatiales, alors qu'elles sont très faibles entre les couches de fluide.
Ainsi, lorsqu'une force est appliquée dans une direction tangentielle sur un liquide, cette force brise les liaisons faibles entre les couches. Cela fait glisser les couches liquides sur l'autre.
Ensuite, lorsque l'application de la force se termine, les forces de cohésion n'ont pas suffisamment de force pour relancer les molécules liquides dans sa position d'origine.
De plus, dans les liquides, la cohésion se reflète également dans la tension de surface, causée par une force déséquilibrée dirigée vers l'intérieur du liquide, agissant sur les molécules de surface.
De même, une cohésion est également observée lorsque la transition de l'état liquide à l'état solide est donnée, en raison de l'effet de la compression des molécules liquides.
En gaz
Dans les gaz, les forces de cohésion sont méprisables. De cette façon, les molécules de gaz sont en mouvement constant, car dans leur cas, les forces de cohésion ne sont pas en mesure de les garder liés les uns aux autres.
Peut vous servir: avantage mécanique: formule, équations, calcul et exemplesPar conséquent, dans les gaz, les forces de cohésion ne peuvent être vues que lorsque le processus de liquéfaction se produit, qui se déroule lorsque les molécules gazeuses sont comprimées et que les forces d'attraction sont suffisamment fortes pour produire la transition de l'état gazeux à l'état liquide.
Exemples de forces de cohésion
Souvent, les forces de cohésion sont combinées avec les forces d'adhésion pour donner naissance à certains phénomènes physiques et chimiques.
Par exemple, les forces de cohésion ainsi que celles de l'adhésion permettent d'expliquer certains des phénomènes les plus courants qui se produisent dans les liquides; C'est le cas du ménisque, de la tension en surface et de la capillarité.
Par conséquent, dans le cas des liquides, il est nécessaire de distinguer les forces de cohésion, qui se produisent entre les molécules du même liquide; et ceux d'adhésion, qui se produisent entre les molécules du liquide et le solide.
Tension superficielle

La tension de surface est la force qui se produit tangentiellement et par unité de longueur sur le bord de la surface libre d'un liquide qui est en équilibre. Cette force contracte la surface liquide.
En fin de compte, la tension de surface se produit parce que les forces qui se produisent dans les molécules liquides sont différentes à la surface du liquide que celles qui se produisent à l'intérieur.
Ménisque
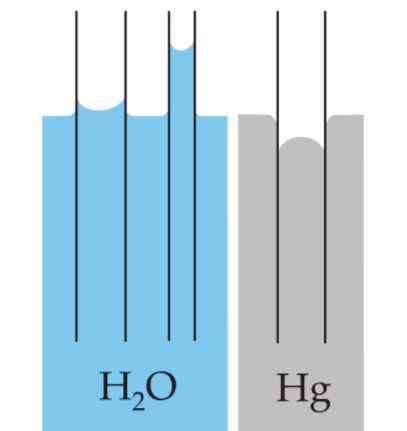
La courbure créée à la surface des liquides est appelée ménisque lorsqu'elle est confinée dans un récipient. Cette courbe est produite par l'effet que la surface du récipient a sur le liquide qui le contient.
Peut vous servir: compteurs de pressionLa courbe peut être convexe ou concave, selon que la force entre les molécules du liquide et celles du récipient est d'attraction - comme c'est le cas de l'eau et du verre - ou de répulsion, comme c'est le cas entre le mercure et le verre.
Capillarité
 Exemple de capillarité
Exemple de capillarité La capillarité est une propriété de fluides qui leur permet de monter ou de descendre à travers un tube capillaire. C'est la propriété qui permet, en partie, la montée de l'eau à l'intérieur des plantes.
Un liquide monte à travers le tube capillaire lorsque les forces de cohésion sont inférieures à celles de l'adhésion entre le liquide et les murs du tube. De cette façon, le liquide continuera de monter jusqu'à ce que la valeur de la tension de surface soit égale au poids du liquide contenu dans le tube capillaire.
Au contraire, si les forces de cohésion sont plus élevées que celles de l'adhésion, la tension de surface descendra au liquide et la forme de sa surface sera convexe.
Les références
- Cohésion (chimie) (n.d.). À Wikipedia. Récupéré de.Wikipédia.org.
- Tension de surface (n.d.). À Wikipedia. Récupéré de.Wikipédia.org.
- Capillarité (n.d.). À Wikipedia. Récupéré de es.Wikipédia.org.
- L'Iran. Levine; "Physicochimie" Volume 1; Cinquième édition; 2004; MC Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chimie: la science moléculaire. Belmont, CA: Brooks / Cole.
- Blanc, Harvey et. (1948). Physique du collège moderne. Van Nostrand.


