Formule moléculaire comment le sortir, exemples et exercices
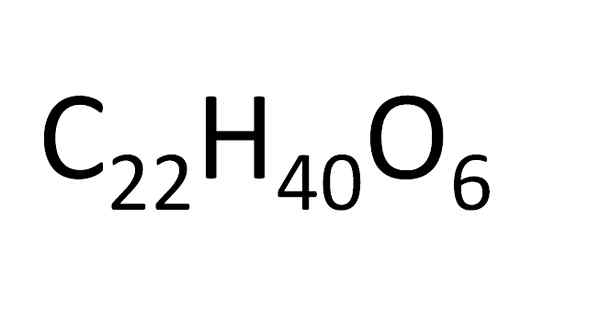
- 4187
- 918
- Raphaël Meyer
La formule moléculaire Il s'agit d'une représentation d'une molécule d'un composé, dans lequel elles sont indiquées, à travers ses symboles chimiques, les atomes de tous les éléments présents dans le composé et le nombre d'entre eux. Chaque atome est accompagné d'un indice.
La formule moléculaire a la limitation qui n'indique pas les liens des différents atomes de la molécule ou leur relation spatiale; comme exprimé par la formule structurelle. Dans certains cas, il n'est pas spécifique, par exemple: C6H12SOIT6 C'est la formule moléculaire du glucose, du galactose et du fructose.
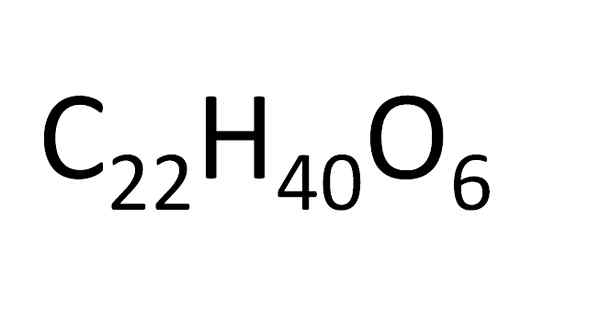 À partir de la même formule moléculaire, des composés isomères sans fin peuvent être obtenus. Cela correspond à une masse moléculaire élevée variable à composé organique. Source: Gabriel Bolívar.
À partir de la même formule moléculaire, des composés isomères sans fin peuvent être obtenus. Cela correspond à une masse moléculaire élevée variable à composé organique. Source: Gabriel Bolívar. Il existe un ensemble de règles pour l'élimination des atomes dans une formule moléculaire. Pour les sels ioniques, par exemple le chlorure de sodium, le symbole de cation est d'abord placé (na+) puis le symbole anion (CL-). C'est pourquoi la formule moléculaire du chlorure de sodium est NaCl.
La formule moléculaire des composés organiques est écrite en plaçant d'abord le symbole du carbone (C), suivie du symbole d'hydrogène (H) puis des atomes restants. Par exemple, la formule moléculaire de l'acide acétique est C2H4SOIT2.
[TOC]
Comment obtenir la formule moléculaire
L'obtention de la formule moléculaire d'un composé est basée sur l'établissement précédent de la formule minimale ou empirique de la même. Pour cette raison, les étapes initiales dans l'obtention des deux formules sont courantes.
Premier pas
L'expression de la masse des éléments d'un composé chimique sous forme de pourcentage est habituelle. Un calcul simple doit ensuite être effectué pour transformer les pourcentages de masse des différents éléments en leurs masses exprimées en grammes.
Peut vous servir: concentration en pourcentageDeuxième pas
Connaissant la masse en gramme de chacun des éléments et sa masse atomique, vous pouvez obtenir le nombre relatif de chaque atome ou le nombre de moles de chaque atome divisant la masse de chacun des différents éléments entre sa masse atomique.
Troisième étape
Le nombre relatif de tous atomes, entre le nombre relatif de valeur inférieure. Les valeurs de proportion minimale doivent être un nombre entier. Dans le cas où une valeur de la proportion contient une décimale, une correction doit être apportée qui fait disparaître une telle décimale.
La correction consiste à multiplier toutes les valeurs de la proportion par un nombre qui revient à toutes les valeurs. Par exemple, si une valeur de proportion minimale est 1.25, toutes les valeurs doivent être multipliées par quatre (4). Depuis 1.25 multiplié par 4 est égal à 5, un entier.
Quatrième étape
Tous les symboles chimiques des éléments du composé seront placés et avec leur indice correspondant; c'est-à-dire la valeur de la proportion minimale de l'élément.
Cinquième étape
La formule minimale d'un composé peut être transformée en sa formule moléculaire en obtenant la relation entre le poids moléculaire du composé et le poids de sa formule minimale (N). Cette relation est la même qui existe entre la formule moléculaire et la formule minimale.
n = poids moléculaire du composé / poids de la formule minimale
Pour obtenir la formule moléculaire, la formule minimale doit être multipliée par n. Cela implique que chacun des indices de la formule minimale doit être multiplié par n.
n = poids moléculaire / poids de formule minimum
= Formule moléculaire / formule minimale
Peut vous servir: Oxygène: propriétés, structure, risques, utilisationsFormule moléculaire = n · formule minimale
Exemples de formules moléculaires
Voici quelques formules moléculaires courantes:
-Oxyde ferreux (moche)
-Hydroxyde de sodium (NaOH)
-Oxyde de potassium (k2SOIT)
-Oxyde perchlorique (Cl2SOIT7)
-Hydroxyde ferrique [Faith (OH)3]]
-Chlorure de calcium (CACL2)
-Acide chlorhydrique (HCL)
-Sulfate de sodium (n2Swin4)
-Acide sulfurique (h2Swin4)
-Acide perbromique (HBRO4)
-Chlorure d'aluminium (alcl3)
-Méthane (ch4)
-Propane (c3H8)
-Etano (c2H6)
-Alcool éthylique (C2H6SOIT)
-Acide acétique (c2H4SOIT2)
-Benzène (c6H6)
-Glucose (c6H12SOIT6)
Exercices résolus
- Exercice 1
Metyl Benzoate a les pourcentages de masse suivants:
C: 70,57%,
H: 5,93%
O: 23,49%
Et un poids moléculaire de 136,1 g / mol. Déterminer la formule moléculaire.
Premier pas
La première étape consiste à exprimer les pourcentages de masse des éléments dans leurs masses en grammes, sachant que les pourcentages de masse sont en relation avec le poids moléculaire.
Des 136,1 grammes correspondant à la mole du composé, 70,57% ne représente que le carbone. Et ainsi de suite avec les éléments restants:
Masse de carbone = 136,1 g · (70,57 / 100)
= 96,05 g
Masse d'hydrogène = 136,1 g · (5,93 / 100)
= 8,06 g
Masse d'oxygène = 136,1 · (23,49 / 100)
= 31,96 g
Deuxième pas
Dans l'élaboration de la formule moléculaire, les nombres relatifs des atomes (NRA) doivent être déterminés. Pour ce faire, les masses des éléments sont divisées entre leurs masses atomiques:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Troisième étape
Nous devons alors calculer les proportions minimales des éléments (PME). Pour cela, toutes les valeurs de la NRA sont divisées entre la valeur de la NRA mineure:
PMe (c) = 8/2
= 4
PMe (h) = 8/2
= 4
PMe (o) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale de benzoate de méthyle, en fonction du fait que les indices des éléments sont leurs proportions minimales calculées:
Peut vous servir: dichromate de sodium (NA2CR2O7): propriétés, production, utilisationsC4H4SOIT
Cinquième étape
Enfin, la formule moléculaire du benzoate de méthyle doit être établie. Nous calculons alors:
n = poids moléculaire / poids de formule minimum
Le poids minimum de la formule devient 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Formule moléculaire = 2 · formule minimale
= 2 · C4H4SOIT
Formule moléculaire de méthyl benzoate = C8H8SOIT2
- Exercice 2
Les pourcentages des éléments qui forment le benzène sont les suivants:
C: 92,36%
H: 7,64%.
Le poids moléculaire du benzène est de 78 g / mol. Déterminer sa formule moléculaire.
Premier pas
Transformez les pourcentages de masse des éléments en leurs masses en grammes:
Masse du carbone = 78 g · (92,36 / 100)
= 72,04 g
Masse d'hydrogène = 78 g · (7,64 / 100)
= 5,96 g
Deuxième pas
Calcul du nombre relatif des atomes (NRA). Pour ce faire, les masses des éléments sont divisées entre leurs masses atomiques:
NRA (C) = 72 g / 12 g
= 6
Nra (h) = 6 g / 1 g
= 6
Troisième étape
Calcul des valeurs de la proportion minimale des éléments (PME). Ceci est calculé en divisant les valeurs de la NRA de tous les éléments entre la valeur inférieure de la NRA:
PMe (c) = 6/6
= 1
PMe (h) = 6/6
= 1
Quatrième étape
Acte de la formule minimale de benzène, en tenant compte que les indices des éléments sont les valeurs de la proportion minimale calculée.
Formule minimale de benzène: Ch
Cinquième étape
Établissement de la formule moléculaire en calculant la relation entre la masse moléculaire et la masse de la formule minimale:
n = poids moléculaire / poids de formule minimum
= 78 g / 13 g
n = 6
Formule moléculaire = n · formule minimale
= 6 · ch
= C6H6
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Formule chimique. Récupéré de: dans.Wikipédia.org
- Apprentissage sans limites. (s.F.). Formules moléculaires. Récupéré de: cours.Lumenarning.com
- Helmestine, Anne Marie, Ph.D. (29 septembre 2019). Formules de calcul empirique et moléculaire. Récupéré de: Thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Comment utiliser des formules empiriques pour trouver des formules moléculaires. Récupéré de: mannequins.com
- « Formule minimale Comment supprimer la formule minimale, des exemples et des exercices
- Histoire de la mondialisation, caractéristiques, causes, conséquences »

