Formule condensée ce qui est et des exemples (méthane, éthane, glucose ...)
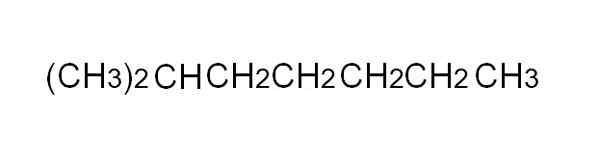
- 1530
- 127
- Justine Charpentier
La formule condensée C'est une représentation purement textuelle d'une molécule dans laquelle les liens sont omis. Son but est de savoir quelle est l'ordre des atomes. Les molécules généralement linéaires ou ramifiées ont des formules condensées, sauf cyclique ou celles qui sont très ramifiées.
En chimie organique, il y a généralement une confusion de la différence entre cette formule et moléculaire. En fait, il est courant de les trouver comme des synonymes. Pendant ce temps, dans la chimie inorganique, les formules moléculaires sont plus utilisées, car dans la plupart des cas, les composés covalents décrivent à juste titre; Comme l'eau, h2SOIT.
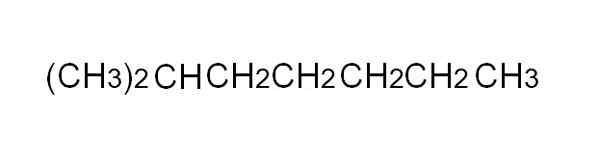 Formule condensée de 2-méthylheptano. Source: Gabriel Bolívar.
Formule condensée de 2-méthylheptano. Source: Gabriel Bolívar. [TOC]
Quelle est la formule condensée?
Pour le définir plus facilement, la formule condensée est une représentation simplifiée du semi-développé. Il n'est pas nécessaire d'écrire les liens simples, et il ne devrait pas couvrir plus d'une ligne dans un texte. Par exemple, le 2-méthylheptano, un alcane ramifié, peut être représenté dans la même ligne que dans l'image supérieure.
Les formules condensées sont utiles pour représenter certaines molécules sans avoir à les dessiner. Ceci est excellent lorsque les équations chimiques sont écrites là où les molécules cycliques ou très ramifiées ne participent pas. On verra que ces formules recourent à des parenthèses pour simplifier davantage la représentation d'une molécule.
Exemples
Méthane
Le méthane est le seul composé chimique qui a une seule formule: ch4. Cela correspond à l'empirique, moléculaire, condensé et semi-développé en même temps. C'est pourquoi plusieurs fois, pour sauver une confusion entre tous ces concepts, les gens préfèrent se référer simple et imprécis à la «formule chimique» d'un composé.
Etano
Estano a une formule moléculaire C2H6. La formule condensée est à la place Cho3Ch3. Notez que le lien C-C et les liens C-H sont omis. L'idée est de pouvoir écrire la formule comme s'il s'agissait d'un "mot", sans avoir à dessiner des rayures ou dessiner des structures.
Peut vous servir: pycnomètrePar définition, la formule moléculaire est C2H6 Et pas ch3Ch3; Cependant, pour les molécules simples, les deux formules sont habituelles à échanger, bien qu'elle soit encore incorrecte. Il s'agit d'un point d'écart entre plusieurs sources, où il y a apparemment des règles spécifiques à cet égard.
Glucose et fructose
Voici un exemple où une erreur est immédiatement observée lorsque vous souhaitez échanger la formule moléculaire contre le condensat.
Le couple sucré, du glucose et du fructose a la même formule moléculaire: C6H12SOIT6, Et donc cela ne sert pas à les différencier. En revanche, les formules structurelles et semi-développées établissent différentes molécules en vue.
Cependant, le glucose ou le fructose ont une formule condensée. En effet, quelle que soit leur représentation ou leur projection, leurs structures ne peuvent pas être écrites dans la même ligne; Ou du moins, d'une manière agréable et simple dans les yeux du lecteur.
Butane
Butano a une formule moléculaire C4Hdix. Il a deux isomères: le linéaire, n-Butano et ramifié, 2-méthylpropane. Les deux peuvent être représentés par leurs formules condensées. Il n-Butano est ch3Ch2Ch2Ch3 ou ch3(Ch2)2Ch3, Et le 2-méthylpropane est Cho3Ch (ch3)2 ou (ch3)3Ch.
Dans le 2-méthylpropane, nous avons un groupe CH entouré de trois cho3. Ses deux formules sont valides et les parenthèses sont utilisées pour mettre en évidence les ramifications, l'abonnement étant un indicateur du nombre de groupes composent cette branche.
Éthanol
L'éthanol a une formule condensée ch3Ch2Oh. Notez à quel point il ressemble à sa formule semi-développée: CH3-Ch2-Oh. De la même manière que cela se fait avec le propanol, Cho3Ch2Ch2Oh, le n-Butanol, ch3Ch2Ch2Ch2Oh, et avec tous les autres alcools.
Peut vous servir: phosphate de sodium: structure, propriétés, synthèse, utilisationsS'ils ont une branche, il sera indiqué dans une parenthèse à droite de l'atome avec lequel il est lié. Par exemple, le 2-méthylbutanol pourrait être écrit comme: ch3Ch2Ch (ch3) Ch2Oh. Notez que pour de nombreuses molécules, il commence à être plus pratique pour recourir à une formule structurelle ou semi-développée.
Pentano
L'isomère linéaire du Pentan, n-Pentano, il est facile à représenter pour sa formule condensée: CHO3Ch2Ch2Ch2Ch3. Cette formule peut également être simplifiée à l'aide de parenthèses: ch3(Ch2)3Ch3, indiquant que entre les deux ch3 Il y a trois ch2.
Les deux autres isomères du pentan, cependant, sont un peu plus compliqués: ch3Ch2Ch (ch3)2, Pour le 2-méthylbutane et c (ch3)4 Pour 2,2-diméthylpropane ou néopantum. Notez que l'atome de carbone à gauche de la parenthèse est celui qui forme des liens vers des substituants ou des ramifications.
Octane
L'isomère linéaire de l'octane, n-Octane, en raison de sa longueur, il est désormais approprié de représenter sa formule condensée sous le nom de Cho3(Ch2)6Ch3. C'est à ce stade que quelque chose de clair des formules condensées devrait être: ils cherchent à gagner du temps lorsqu'ils représentent des molécules ou des composés, sans écrire autant sur papier.
Cyclohexan
Le cas du cyclohexan est similaire à celui du glucose et du fructose: manque officiellement d'une formule condensée pour être un composé cyclique. Une façon d'essayer de le représenter serait: (ch2)6, ce qui implique que six groupes Cho2 Ils doivent être liés, n'étant possibles que s'ils ferment dans un anneau hexagonal. Cependant, il vaut mieux dessiner l'anneau.
Acétone
L'acétone présente la particularité de la possession d'un groupe carbonyle, c = o. Par conséquent, pour écrire votre formule condensée, nous avons trois options: (ch3)2CO, CH3C (o) ch3 ou ch3(C = o) ch3.
Peut vous servir: acide de café: structure, propriétés, biosynthèse, utilisationsEn fait, dans les molécules plus grandes, le groupe carbonyle est généralement représenté comme (o), en tenant compte que l'atome de carbone à sa gauche est celui qui forme la double liaison avec l'oxygène, c = o.
Acide acétique
La formule condensée de l'acide acétique est Cho3COOH O CH3CO2H. Voici un point important: les groupes fonctionnels écrits dans la même ligne font partie d'une formule condensée. Ce fut le cas de l'éthanol et de l'acétone, et s'applique également aux thioles (-sh), aldéhydos (-cho) les esters (-co2R o -coor) et amines (-nh2).
Commentaire général
Il existe de nombreuses confusion entre les formules moléculaires et condensées. C'est peut-être parce que ces représentations à elles seules fournissent déjà une image approximative de la molécule, nous pensons donc que c'est la formule moléculaire.
De plus, des formules telles que C6H12SOIT6 Ils sont également considérés comme un condensat, car ils sont simplifiés, "condense" la molécule dans les atomes et les indices. C'est pourquoi il est courant de voir comment les deux formules sont mentionnées comme s'ils étaient des synonymes.
Dans de nombreuses sources, y compris les articles de Wikipedia, les termes «formule chimique» sont utilisés pour faire référence à la moléculaire (Type C6H12SOIT6 et autres), et «formule» pour se référer au condensat.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (18 novembre 2019). Définition de formule condensée en chimie. Récupéré de: Thoughtco.com
- James Ashenhurst. (11 décembre 2019). Formules condensées: déchiffrer ce que signifie le dos. Maître chimie organique. Récupéré de: MasterOganicchemistry.com
- Copolingerieria. (2 mai 2016). Formule empirique, structurelle et condensat. Récupéré de: chiiotecablog.Wordpress.com
- Introduction à la chimie: général, organique et biologique. (s.F.). Formules structurelles et à angle de ligne condensées. Récupéré de: 2012 livres.Lardbucket.org

