Structure de phosphouro en aluminium (AIP), propriétés, utilisations, risques

- 4857
- 805
- Paul Dumas
Il phosphure d'aluminium Il s'agit d'un composé inorganique formé par un atome d'aluminium (AL) et un atome de phosphore (P). Sa formule chimique l'alp. C'est un solide gris foncé ou, s'il est très pur, jaune. C'est un composé extrêmement toxique pour les êtres vivants.
L'aluminium phosphuro réagit avec l'humidité pour former du phosphine ou du phosphano pH3, qui est un gaz toxique. Pour cette raison, l'ALP ne doit pas contacter l'eau. Réagit fortement avec les acides et les solutions alcalines.
 Phosphure d'aluminium. همان [gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons.
Phosphure d'aluminium. همان [gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons. Il a été utilisé dans le passé pour éliminer les ravageurs tels que les insectes et les rongeurs dans des endroits où les céréales et les autres produits agricoles ont été stockés. Cependant, en raison de son danger élevé, il a été interdit dans la plupart des pays du monde.
Actuellement, son utilité dans la zone électronique est théoriquement étudiée par des ordinateurs qui calculent la possibilité d'obtenir des nanotubes de semi-conducteurs, c'est-à-dire des tubes extrêmement petits qui ne peuvent transmettre l'électricité que dans certaines conditions.
Le phosphuro en aluminium est un composé très dangereux, il doit être manipulé avec des outils de sécurité tels que des gants, des lentilles, de l'équipement respiratoire et des vêtements de protection.
[TOC]
Structure
ALP Aluminium Phosphuro est formé par l'union d'un atome en aluminium au phosphore p atome p. Le lien entre les deux est covalent et triple, donc il est très fort.
L'aluminium dans l'ALP a un état d'oxydation de +3 et le phosphore a une valence de -3.
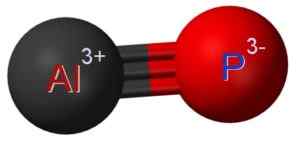 Structure de phosphouro en aluminium où vous pouvez voir le triple lien entre les atomes de l'aluminium (AL) et le phosphore (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Structure de phosphouro en aluminium où vous pouvez voir le triple lien entre les atomes de l'aluminium (AL) et le phosphore (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Nomenclature
- Phosphure d'aluminium
Propriétés
État physique
Gris foncé classique cristallin ou jaune foncé. Cristaux cubes.
Poids moléculaire
57 9553 g / mol
Point de fusion
2550 ºC
Densité
2,40 g / cm3 à 25 ° C
Solubilité
Il se décompose dans l'eau.
Propriétés chimiques
Réagit avec l'humidité pour donner du phosphine ou du phosphano pH3 qui est un composé inflammable et toxique. Phosphine ou phosphaan.
Peut vous servir: gadolinio: structure, propriétés, obtention, utilisationsLa réaction au phosphouro en aluminium avec l'eau est la suivante:
Phosphouro en aluminium + eau → Hydroxyde d'aluminium + phosphine
ALP + 3 H2O → à (oh)3 + PH3↑
Les présentations commerciales ont du carbonate d'aluminium pour le2(CO3)3 Pour éviter l'auto-direction de la phosphine qui se produit lorsque l'ALP entre en contact avec l'humidité de l'air.
L'ALP est stable lorsqu'il est sec. Réagit violemment avec les acides et les solutions alcalines.
Le phosphouro en aluminium ALP ne fait pas fondre, ni sublimale ou se décompose thermiquement à des températures pouvant atteindre 1000 ° C. Même à cette température, sa pression de vapeur est très faible, c'est-à-dire qu'elle n'évapore pas à cette température.
Lorsqu'il est chauffé à sa décomposition émet des oxydes de phosphore toxiques. En contact avec les métaux, vous pouvez émettre des gaz hydrogène inflammables H2.
Autres propriétés
Quand il est pur, il montre une coloration jaunâtre, lorsqu'elle est mélangée avec des restes de la réaction de préparation présente la couleur du gris au noir.
Sa faible volatilité exclut qu'elle a une odeur, donc l'odeur de l'ail qui émet parfois est due au pH de la phosphine3 qui se forme en présence d'humidité.
Obtention
Le phosphouro en aluminium peut être obtenu en chauffant un mélange de poudre métallique en aluminium (AL) et de l'élément de phosphore rouge (P).
En raison de l'affinité du phosphore (P) par l'oxygène (ou2) et celui de l'aluminium (AL) par l'oxygène et l'azote (n2), La réaction doit être effectuée dans l'atmosphère libre de ces gaz, comme l'atmosphère d'hydrogène (H2) ou gaz naturel.
La réaction commence à chauffer rapidement une zone du mélange jusqu'à ce que la réaction commence, ce qui est exothermique (la chaleur se produit pendant la même chose). À partir de ce moment, la réaction se déroule rapidement.
Aluminium + phosphore → phosphouro en aluminium
4 à + p4 → 4 ALP
Applications
Dans l'élimination des ravageurs (utilisation abandonnée)
Le phosphuro en aluminium a été utilisé dans le passé comme insecticide et comme exterminateur de rongeurs. Cependant, bien qu'il ait été interdit par sa toxicité, il est toujours utilisé dans certaines parties du monde.
Peut vous servir: .Acide stéarique (CH3 (CH2) 16COOH): Structure, propriétés, utilisationsIl est utilisé pour la fumigation dans les espaces fermés où des produits alimentaires transformés ou non transformés se trouvent (comme les céréales), la nourriture pour les produits animaux et non alimentaires.
L'objectif est de contrôler les insectes et les rongeurs qui attaquent les articles stockés, qu'ils soient comestibles ou non.
Il permet de contrôler les rongeurs et les insectes dans des zones non domestiques, agricoles ou non agricoles, de fumigation à l'extérieur ou dans leurs terriers et nids pour empêcher certaines maladies de transmettre.
 Les rats et les souris sont des ravageurs qui attaquent les lieux de stockage des céréales. Il y a quelques années, ils se sont battus avec du phosphouro en aluminium. Auteur: Andreas N. Source: Pixabay.
Les rats et les souris sont des ravageurs qui attaquent les lieux de stockage des céréales. Il y a quelques années, ils se sont battus avec du phosphouro en aluminium. Auteur: Andreas N. Source: Pixabay.  Les rongeurs ont été contrôlés en plaçant le phosphouro en aluminium dans leurs terriers. Auteur: Photo-Rabe. Source: Pixabay.
Les rongeurs ont été contrôlés en plaçant le phosphouro en aluminium dans leurs terriers. Auteur: Photo-Rabe. Source: Pixabay. Sa forme d'utilisation consiste à exposition de l'ALP dans l'air ou l'humidité, car la phosphine ou le pH phosphaan est libérée3 qui génère des dommages à de nombreux organes de peste pour éliminer.
 Les insectes ont également été éliminés avec ALP en aluminium phosphuro. Auteur: Michael Power. Source: Unsetpash.
Les insectes ont également été éliminés avec ALP en aluminium phosphuro. Auteur: Michael Power. Source: Unsetpash. Dans d'autres applications
Le phosphuro en aluminium ALP est utilisé comme source de phosphine ou de phosphano pH3 et est utilisé dans la recherche sur les semi-conducteurs.
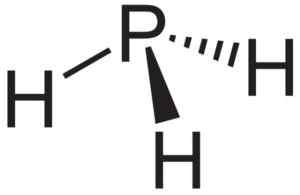 Phosphaano ou phosphine pH3, composé qui se forme lorsque le phosphouro en aluminium ALP entre en contact avec l'eau. Neuroteker [domaine public]. Source: Wikimedia Commons.
Phosphaano ou phosphine pH3, composé qui se forme lorsque le phosphouro en aluminium ALP entre en contact avec l'eau. Neuroteker [domaine public]. Source: Wikimedia Commons. Recherche théorique des nanotubes d'ALP
Des études théoriques ont été menées sur la formation de nanotubes de phosphouro en aluminium ALP. Les nanotubes sont très petits et très minces des cylindres qui ne peuvent être visibles qu'avec un microscope électronique.
Nanotubes ALP avec bore
Les études théoriques menées par des calculs de calcul montrent que les impuretés qui pourraient être ajoutées aux nanotubes de l'ALP pourraient changer les propriétés théoriques de ces.
Par exemple, on estime que l'ajout d'atomes de bore (b) aux nanotubes ALP pourrait les transformer en semi-conducteurs de type-p. Un semi-conducteur est un matériau qui se comporte comme un conducteur d'électricité ou comme isolant en fonction du champ électrique auquel il est soumis.
Peut vous servir: État du plasma: caractéristiques, types et exemplesEt un semi-conducteur de type-p C'est lorsque le matériau est ajouté d'impuretés, dans ce cas, l'ALP est le matériau de départ et les atomes de bore seraient des impuretés. Les semi-conducteurs sont utiles pour les applications électroniques.
Nanotubes ALP avec structure modifiée
Certains scientifiques ont effectué des calculs pour déterminer l'effet du changement de la structure du réseau cristallin des nanotubes d'ALP de l'hexagonal à l'octaédrique.
Ils ont constaté que la manipulation de la structure du réseau cristallin pouvait être utilisée pour ajuster la conductivité et la réactivité des nanotubes ALP et les concevoir afin qu'ils soient utiles pour les applications électroniques et optiques.
Des risques
Le contact avec l'aluminium phosphuro peut irriter la peau, les yeux et les muqueuses. S'il est ingéré ou inhalé, il est toxique. Il peut être absorbé par la peau avec des effets toxiques.
Si l'ALP entre en contact avec l'eau réagit et la forme de phosphine ou le pH du phosphane3 qui est extrêmement inflammable car il brûle en contact avec l'air. Par conséquent, il peut exploiter. De plus, la phosphine provoque la mort des humains et des animaux.
Étant donné qu'un pesticide économique est le phosphouro en aluminium, son utilisation est une cause courante d'empoisonnement des gens et implique un taux de mortalité élevé.
 Le phosphouro en aluminium est extrêmement dangereux. Auteur: Vecteurs d'OpenClipart. Source: Pixabay.
Le phosphouro en aluminium est extrêmement dangereux. Auteur: Vecteurs d'OpenClipart. Source: Pixabay. Réagit avec l'humidité des muqueuses et avec l'acide chlorhydrique HCL de l'estomac formant le phosphane de phosphane très toxique3. Par conséquent, par inhalation et ingestion, la phosphine se forme dans le corps, avec des effets mortels.
Son ingestion provoque une hémorragie du tractus gastro-intestinal, un effondrement cardiovasculaire, des troubles neuropsychiatriques, une insuffisance respiratoire et rénale en quelques heures.
L'ALP est très toxique pour tous les animaux terrestres et aquatiques.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Phosphure d'aluminium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Sjögren, b. et al. (2007). Aluminium. Autres composés en aluminium. Dans Handbook on the Toxicology of Metals (troisième édition). Récupéré de ScienceDirect.com.
- Gupta, R.C. et Crissman, J.W. (2013). Évaluation de la sécurité, y compris les problèmes actuels et émergents en pathologie toxicologique. Risque humain. Dans Haschek et Rousseaux, Handbook of Toxicology Pathology (troisième édition). Récupéré de ScienceDirect.com.
- Blanc, w.ET. et Bushey, à.H. (1944). Phhosphure d'aluminium - Préparation et composition. Journal de l'American Chemical Society 1944, 66, 10, 1666-1672. Récupéré des pubs.ACS.org.
- Mirzaei, Maryam et Mirzaei, Mahmoud. (2011). Une étude théorique des nanotubes de phosphure d'aluminium de bore-due. COMPUTATION ET THÉORATIQUE CHIMIE 963 (2011) 294-297. Récupéré de ScienceDirect.com.
- Takahashi, L. Et takahashi, k. (2018). Réglage de la structure électronique d'un nanotube de phosphure d'aluminium. ACS Appl. Nano-mater. 2018, 1, 501-504. Récupéré des pubs.ACS.org.
- Gupta, P.K. (2016). Effets toxiques des pesicides (agrochimiques). Phosphure d'aluminium. En fonds de toxicologie. Récupéré de ScienceDirect.com.
- « Coordonnées rectangulaires Exemples et exercices résolus
- Degré de polynôme comment il est déterminé, exemples et exercices »

