Structure de phosphate en aluminium (Alpo4), propriétés, obtention, utilisations

- 4109
- 876
- Lucas Schneider
Il Phosphate d'aluminium C'est un solide inorganique formé par un ion en aluminium à la3+ et un phosphate ion po43-. Sa formule chimique est alpo4. C'est un solide blanc dont la structure cristalline est similaire à celle de la silice sio2. C'est insoluble dans l'eau.
Il peut être obtenu en alumine (à2SOIT3) et l'acide phosphorique (H3Pote4). Il peut également être obtenu sur la base de solutions aqueuses de chlorure d'aluminium (ALCL3) et le phosphate de sodium (Na3Pote4).
 Phosphate d'aluminium alpo4. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons.
Phosphate d'aluminium alpo4. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons. Le phosphate en aluminium a un point de fusion très élevé, il est donc largement utilisé comme composant de la céramique réfractaire, c'est-à-dire des céramiques qui supportent des températures très élevées.
Il est également utilisé comme antiacide pour l'estomac, dans des mélanges pour la réparation des dents et comme adjuvant des vaccins, c'est-à-dire pour stimuler la réponse immunitaire de l'organisme.
Certains béton réfractaire ont l'alpo4 Dans sa composition, qui augmente les propriétés mécaniques et de soutien à des températures élevées de ce type de ciment.
Il a été utilisé comme bouclier protecteur pour éviter les matériaux combustibles comme certains polymères.
[TOC]
Structure
L'alpo4 Il est formé par un cation en aluminium au3+ et un PO anion phosphate43-.
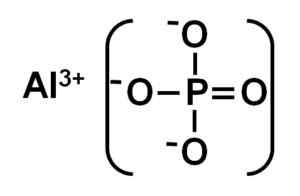 Structure ionique du phosphate d'aluminium. Auteur: Marilú Stea.
Structure ionique du phosphate d'aluminium. Auteur: Marilú Stea. Le phosphate cristallin en aluminium est également appelé phase berlinite ou alpha (α-alpo4) Et ses cristaux sont similaires au quartz.
 Cristaux synthétiques berlinites (α-alpo4). Dmgualtieri [cc by-sa (https: // creveVecommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Cristaux synthétiques berlinites (α-alpo4). Dmgualtieri [cc by-sa (https: // creveVecommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. La phase alpha du phosphate en aluminium est solide formée par un réseau covalent de tétraèdre Po4 et alpo4 qui alternent et sont unis par des atomes d'oxygène.
Cette structure est isomorphe avec de la silice, c'est-à-dire qu'elle a la même forme que celle du SIO2.
Nomenclature
- Phosphate d'aluminium
- Monophosphate d'aluminium
- Sel d'aluminium acide phosphorique.
Propriétés
État physique
Solide blanc cristallin.
Poids moléculaire
121,93 g / mol
Point de fusion
1800 ºC
Densité
2,56 g / cm3
Solubilité
Insoluble dans l'eau
Autres propriétés
La structure alpo4 C'est très similaire à celui de la silice sio2, il partage donc de nombreuses propriétés physiques et chimiques.
Peut vous servir: eau dissionnéeLe phosphate en aluminium est un matériau très réfractaire, c'est-à-dire qu'il résiste à des températures très élevées sans changer sa condition physique ou sa structure et sans décomposition.
L'alpo4 Cristallin ou berlinite Lorsqu'il est chauffé, il devient une structure de type thundimite puis de type christobalite, d'autres formes de ce composé qui le ressemblent à la silice silia2.
 Phosphate d'aluminium. CHIMICALICTEREST [DOMAINE PUBLIC]. Source: Wikimedia Commons.
Phosphate d'aluminium. CHIMICALICTEREST [DOMAINE PUBLIC]. Source: Wikimedia Commons. Obtention
Phosphate d'aluminium alpo4 Il peut être obtenu par réaction entre l'acide phosphorique H3Pote4 et Alumina Al2SOIT3. Une application de température est requise, par exemple entre 100 et 150 ° C.
Au2SOIT3 + 2 h3Pote4 = 2 alpo4 + 3 h2SOIT
Il peut également être obtenu en rejoignant une solution aqueuse de chlorure d'aluminium alcl3 avec une solution aqueuse de phosphate de sodium na3Pote4:
ALCL3 + N / A3Pote4 = Alpo4 + 3 NaCl
Utiliser dans la céramique
Phosphate d'aluminium alpo4 Il se trouve souvent dans la constitution de la céramique d'alumine.
La céramique à forte teneur en alumine est l'un des matériaux utilisés dans les applications dans lesquelles il est nécessaire pour résister à des charges élevées et des conditions sévères.
Ce type de céramique est résistant à la corrosion, aux environnements à haute température, à la présence de vapeur chaude ou dans des atmosphères réductrices telles que le monoxyde de carbone (CO).
La céramique en alumine a également une faible conductivité électrique et thermique, il est donc utilisé pour fabriquer des briques réfractaires et des composants isolants de l'électricité.
 Revêtement en brique réfractaire qui peut contenir du phosphate d'aluminium alpoo4. Ces briques protègent des températures élevées. Alexknight12 [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Revêtement en brique réfractaire qui peut contenir du phosphate d'aluminium alpoo4. Ces briques protègent des températures élevées. Alexknight12 [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Parce que le phosphate d'aluminium se forme à une température beaucoup plus bas2, Sa production est moins chère, ce qui constitue un avantage dans la fabrication de céramiques adaptées aux services exigeants.
Fabrication de céramique phosphate en aluminium
L'alumine est utilisée pour2SOIT3 et l'acide phosphorique H3Pote4 En milieu aqueux.
Le pH de formation préféré est de 2 à 82Pote4- et hpo42-. Une concentration d'ions acides à3+ Il est élevé, de la dissolution de l'alumine à la2SOIT3.
Peut vous servir: tétrachlorure de carbone (CCL4)En premier lieu, un gel de trihydrogène diphardrogène en aluminium en aluminium ALH3(Po4)2.H2SOIT:
Au3+ + H2Pote4- + HPO42- + H2Ou ⇔ alh3(Po4)3.H2SOIT
Cependant, il arrive un moment où le pH de la solution basse et devient neutre, où l'alumine à la2SOIT3 présente une faible solubilité. À l'heure actuelle, l'alumine insoluble forme une couche à la surface des particules empêchant la réaction de continuer.
Par conséquent, il est nécessaire d'augmenter la solubilité de l'alumine et cela est réalisé en douceur. En chauffant à 150 ° C, le gel continue la réaction avec l'alumine à la2SOIT3 libérer de l'eau et forme la berlinita cristalline (alpha-alpo4).
Au2SOIT3 + 2 ALH3(Po4)3.H2O → Alpo4 + 4 h2SOIT
Berlinita rejoint les particules individuelles et la céramique se forment.
Autres utilisations
L'alpo4 Il est utilisé comme antiacide, comme adsorbant, comme tamis moléculaire, comme le support du catalyseur et comme revêtement pour améliorer la résistance à la corrosion chaude. Voici d'autres applications.
Dans l'obtention du béton
Le phosphate en aluminium est un ingrédient de réfractaire ou de béton résistant à la chaleur.
Fournit d'excellentes propriétés mécaniques et réfractants à ces béton, comme la résistance à la chaleur. Dans l'intervalle de température entre 1400-1600 ° C, le béton cellulaire à base de phosphate d'aluminium est l'un des matériaux les plus efficaces tels que l'isolateur thermique.
Il ne nécessite pas de séchage, son durcissement est obtenu par une réaction exothermique auto-propagée. Il est possible de préparer des briques de ce matériau sous n'importe quelle forme et taille.
En ciments dentaires
Le phosphate en aluminium fait partie des ciments dentaires ou matériels qui sont utilisés pour guérir la prothèse cariée.
Dans les ciments dentaires, l'alumine est utilisée comme modérateur des réactions acides-base, où l'effet modérateur est dû à la formation de phosphate d'aluminium sur les particules d'autres matériaux.
Ces ciments ont une compression et une résistance à la tension très élevées, ce qui est dû à la présence de phosphate d'aluminium.
 Les ciments dentaires utilisés pour guérir les caries peuvent contenir du phosphate d'aluminium. Auteur: Gerber Challenge. Source: Pixabay.
Les ciments dentaires utilisés pour guérir les caries peuvent contenir du phosphate d'aluminium. Auteur: Gerber Challenge. Source: Pixabay. Dans les vaccins
L'alpo4 Il est utilisé depuis de nombreuses années dans plusieurs vaccins humains pour améliorer la réponse immunitaire du corps. On dit que Alpo4 C'est un "adjuvant" des vaccins. Le mécanisme n'est pas encore compris.
Peut vous servir: chlorure de lithium (licl): propriétés, risques et utilisationsOn sait que l'effet immunostimulant d'Alpo4 Cela dépend du processus d'adsorption de l'antigène à l'adjuvant, c'est-à-dire la façon dont il adhère à cela. Un antigène est un composé qui lors de l'entrée dans le corps génère la formation d'anticorps pour lutter contre une maladie spécifique.
Les antigènes peuvent être adsorbés à Alpo4 par interactions électrostatiques ou par la liaison avec des ligands. Adsorbe à la surface de l'adjuvant.
On pense également que la taille des particules alpo4 Il a aussi une influence. Une taille de particule inférieure La réponse des anticorps est plus grande et plus durable.
 Les vaccins peuvent contenir du phosphate d'aluminium alpoo4 Pour augmenter son efficacité. Auteur: Tumisu. Source: Pixabay.
Les vaccins peuvent contenir du phosphate d'aluminium alpoo4 Pour augmenter son efficacité. Auteur: Tumisu. Source: Pixabay. En tant que issue de flamme de polymère
L'alpo4 Il a été utilisé comme allumé et évite la combustion ou brûlé de certains polymères.
L'ajout d'Alpo4 à un polymère de polypropylène qui a déjà un retardateur de flamme provoque un effet synergique entre les deux retardateurs, ce qui signifie que l'effet est beaucoup plus grand que celui des deux allume.
Lorsque le polymère est soumis à une combustion ou brûlé en présence d'alpo4, Un métaphosphate d'aluminium est formé qui pénètre la surface carbonisée et remplit les pores et les fissures.
Cela conduit à la formation d'un bouclier protecteur très efficace pour éviter la brûlure ou la combustion du polymère. En d'autres termes, l'alpo4 sceller la surface carbonisée et empêche le polymère de brûler.
 Avec l'alpo4 La combustion de certains polymères peut être retardée. Auteur: Hans Braxmeier. Source: Pixabay.
Avec l'alpo4 La combustion de certains polymères peut être retardée. Auteur: Hans Braxmeier. Source: Pixabay. Les références
- Abyzov, V.POUR. (2016). Béton réfractaire léger à base de liant en aluminium-magnésium-phosphate. Ingénierie de procédure 150 (2016) 1440-1445. Récupéré de ScienceDirect.com.
- Wagh, un.S. (2016). Céramique phosphate en aluminium. En céramique phosphate à liaison chimique (deuxième édition). Chapitre 11. Récupéré de ScienceDirect.com.
- Mei, c. et al. (2019). Vaccin contre le phosphate en aluminium Attjuvant: Analyse de la composition et de la taille Utilisation d'outils hors ligne et en ligne. Comput Struct Biotechnol J. 2019; 17: 1184-1194. NCBI a récupéré.NLM.NIH.Gouvernement.
- Qin, Z. et al. (2019). Effet de barrière synergique du phosphate d'aluminium sur le polypropylène ignifuge à base de système de polyphosphate d'ammonium / dipentaerythitol. Matériaux et conception 181 (2019) 107913. Récupéré de ScienceDirect.com.
- Vrieling, h. et al. (2019). Nanaparticules de phosphate en aluminium stabilisé utilisés comme vaccin contre le vaccin. Colloïdes et surfaces b: Biointerfaces 181 (2019) 648-656. Récupéré de ScienceDirect.com.
- Schaefer, C. (2007). Médicaments gastro-intestinaux. Antiacides. Dans les médicaments pendant la grossesse et la lactation (deuxième édition). Récupéré de ScienceDirect.com.
- Rouquerol, F. et al. (1999). Propriétés de Som New Adsorbants. En adsorption par les puissances et les solides poreux. Récupéré de ScienceDirect.com.
- « La notation a développé ce qui est, des exemples et des exercices
- Origine afro-colombie, histoire, caractéristiques, importance »

