Structure d'éthanamide, propriétés, utilisations, effets
- 1752
- 312
- Raphaël Charles
La éthanamide C'est un produit chimique qui appartient au groupe de composés organiques d'azote. Il est également appelé acétamide, selon l'Union internationale de la chimie pure et appliquée (IUPAC). Commercialement est appelé acide acétique.
Il s'appelle Amida parce que l'azote est lié à un groupe carbonyle. Il est primaire, car il conserve les deux atomes d'hydrogène unis à l'azote -NH2. Il a été trouvé dans la nature comme minéral uniquement en temps sec; Dans la saison pluvieuse ou très humide, il se dissout dans l'eau.
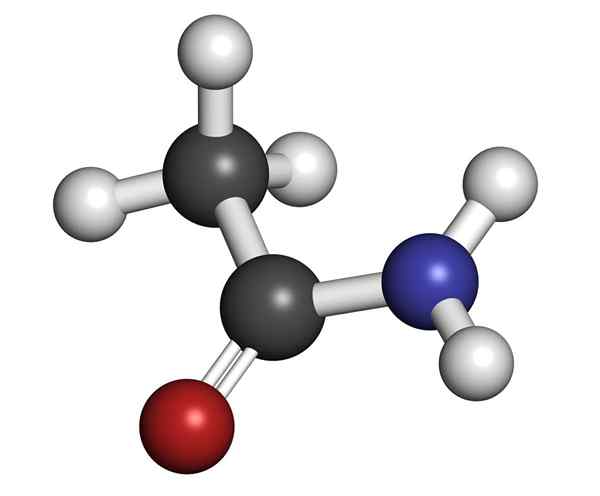 Structure moléculaire de l'acétamide
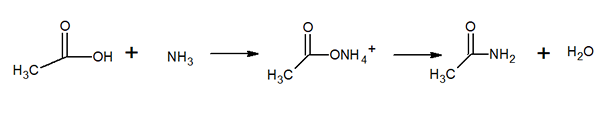
Structure moléculaire de l'acétamide C'est un solide à rattrapage vitreux (transparent). Sa couleur passe de l'incolorant au gris, forme de petites stalactites et parfois des agrégats granulaires. Il peut se produire par la réaction entre l'acide acétique et l'ammoniac, formant un sel intermédiaire: l'acétate d'ammonium. Ensuite, cela est déshydraté pour produire l'amida et former de l'eau:
[TOC]
Structure chimique
La structure chimique interne du cristal d'acétamide est trigonale, mais lors de la réception pour former des agglomérés acquiert une forme octaédrique.
La formule structurelle du composé se compose d'un groupe acétyle et d'un groupe amino:
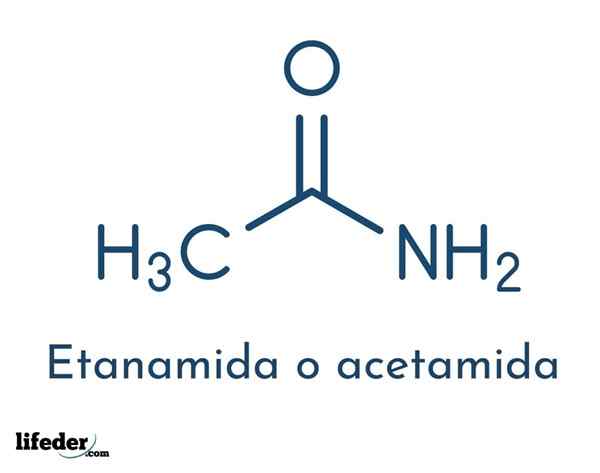
Ces groupes permettent les différentes réactions que le composé peut être effectué. La formule moléculaire de l'acétamide est C2H5NON.
Propriétés physiques de l'éthanamide
Apparence | Ce sont des cristaux qui vont de l'incolorant au gris. |
Odeur | Toilettes. Quand il a des impuretés, il a une odeur d'ammoniac-urea. |
Idée | Il peut être trouvé dans la nature, en plus des mines dans les racines de la betterave à sucre, dans le vin qui s'est oxydé en excès et dans la fumée de tabac. |
Masse molaire | 59.07 g / ml |
Densité d'eau | 1.159 g / cm³ |
Point de fusion | Entre une plage de 79 ° C-81 ° C |
Point d'ébullition | 221 ° C |
Solubilité dans l'eau, éthanol, pyridine, chloroforme, glycérol et benzène | Très soluble |
La pression de vapeur | 1.3x10-5 atm. |
Propriétés chimiques
Les propriétés chimiques d'une substance se réfèrent à leur réactivité lorsqu'elles sont en présence d'autres qui peuvent provoquer une transformation en sa structure. L'acétamide présente les réactions suivantes:
Peut vous servir: Faraday constanteHydrolyse acide et base
Dans l'hydrolyse d'acide, il réagit avec l'acide inorganique à haute température pour former l'acide carboxylique et un sel d'ammonium.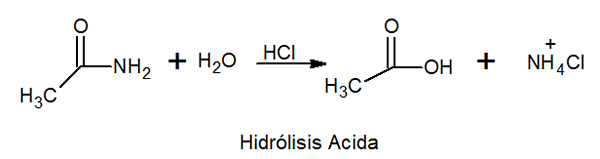
Dans l'hydrolyse de base, le sel métallique et d'ammoniac se produit.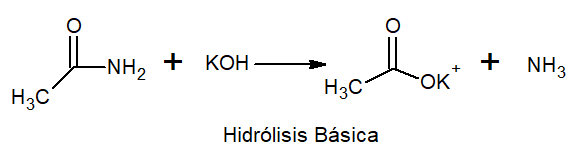
Réduction
La réduction signifie le gain d'hydrogène, donc cette réaction produit une amine primaire appelée éthanamine ou éthylamine. Le réducteur est le lialh de l'hydrure de lithium et de l'aluminium4. 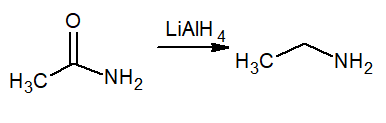
Déshydratation
Ce terme indique une perte d'eau de la molécule. Ils sont utilisés comme réactifs déshydratants2) ou pentoxyde de phosphore (P2SOIT5). Le produit final est un nitrile. 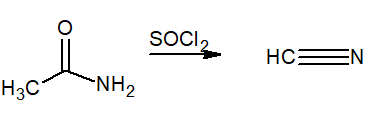
Dans le domaine industriel, la production d'acides carboxyliques est très avantageuse en raison de l'importance de ses dérivés. Cependant, l'obtention de l'acide d'éthane à partir d'acétamide a une application très limitée, car les températures élevées auxquelles le processus se produit a tendance à décomposer l'acide.
En laboratoire, bien que l'éthanamide puisse être obtenu à partir d'acide acétique, la reconversion d'un amide acide est très improbable, et c'est généralement pour tous les amides.
Il peut vous servir: ititrum: structure, propriétés, utilisations, obtentionLes utilisations de l'acétamide
L'acétamide s'est produit commercialement depuis 1920, bien qu'il ne soit pas certain qu'à ce jour, il est en usage commercial. Auparavant, il était utilisé pour la synthèse de la méthylamine, du thioacétamide, des hypnotiques, des insecticides et à des fins médicinales.
L'acétamide est un composé qui, dans le domaine industriel, est utilisé comme:
- Plastification, en cuir, films et revêtements en tissu.
- Additif papier, pour donner une résistance et une flexibilité.
- Dénaturation des alcools. Il est ajouté à l'alcool dans l'étude pour éliminer une partie de la pureté qu'il a et peut donc servir d'autres utilisations, comme le solvant.
- Laquer, pour briller sur les surfaces et / ou pour protéger les matériaux des agressions de l'environnement, en particulier la corrosion.
- Explosif.
- Le fondateur, puisque être ajouté à une substance facilite la fusion de ce.
- En cryoscopie.
- En tant qu'intermédiaire dans l'élaboration de médicaments tels que l'ampicilline et les antibiotiques dérivés de céphalosporines, tels que: maux de tête, céphalexine, chaleur, masteale d'énalapril (traitement par hypertension) et sulfacétamide (gouttes ophtalmiques antimicrobiennes), entre autres.
- Solvant, car certaines substances augmentent la solubilité dans l'eau lorsque l'acétamide est dissous dedans.
- En tant que solvant qui corrige les colorants dans l'industrie textile.
- Dans l'élaboration de la méthylamine.
- En tant que biocide, dans des composés qui peuvent être utilisés comme désinfectants, conservateurs, pesticides, etc.
Effets sur la santé
Dans les industries chimiques où l'acétamide est utilisé comme solvant et plastifiant, les travailleurs peuvent présenter une irritation cutanée en raison d'une (exposition à court terme) par la présence de ces composés.
Il n'y a aucune information sur les effets chroniques (à long terme) ou le développement du cancérogène chez l'homme. Selon l'Agence américaine de protection de l'environnement (EPA), l'acétamide n'est pas classé comme cancérigène.
Il peut vous servir: pas d'électrolytes: caractéristiques et exemplesL'Agence internationale pour la recherche sur le cancer a classé l'acétamide comme un groupe 2B, le cancérogène humain possible.
La California Environmental Protection Agency a établi une estimation du risque d'inhalation de 2 × 10-5 µg / m3 (microgramme par mètre cube) et un risque de cancer de la bouche après 7 × 10 ingestion-2 Mg / kg / j (Milligramos pour chaque kilogramme en une journée) pendant longtemps.
Cependant, bien que la population générale puisse être exposée au tabagisme ou à un contact cutané avec des produits contenant de l'acétamide, il ne représente pas beaucoup de risques en raison des caractéristiques de la solubilité et de l'hygroscopie qu'elle a avec l'eau.
Il peut être facilement déplacé par le sol par le ruissellement, mais il devrait être dégradé par les micro-organismes et ne pas s'accumuler dans le poisson.
L'acétamide est une légère peau et des yeux irritants, et il n'y a pas de données disponibles qui certifient ses effets toxiques sur les humains.
Dans les animaux de laboratoire, une toxicité a été observée dans la perte de poids corporel lorsqu'il est soumis à une dose orale très élevée au fil du temps. Cependant, aucun avortement ou effet nocif n'a été observé dans la naissance des jeunes de parents traités avec de l'acétamide.
Les références
- Cosmos Online, (depuis 1995), Informations techniques et commerciales de l'acétamide, récupérées le 23 mars 2018, Cosmos.com.mx
- Morrison, R., Boyd, R., (1998), Organic Chemistry (5e édition), Mexique, Inter-American Educational Fund, S.A de c.V
- Pins., Hammond, G., Cram, D., Hendrickson, J., (1982). Organic Chemistry, (deuxième édition), Mexique, McGraw-Hill de México, S.A de c.V
- Guide chimique, (2013), Utilisations de l'acétamide, récupérées le 24 mars 2018, Guiadeproductosquimicos.Blogspot.com.co
- Centre national d'information sur la biotechnologie. Base de données de composés PubChem; CID = 178, acétamide. Pubchem récupéré.NCBI.NLM.NIH.Gouvernement

