Structure principale des caractéristiques
- 3400
- 318
- Noa Da silva
La structure primaire des protéines C'est l'ordre dans lequel les acides aminés des polypeptides qui se composent sont disposés. Une protéine est un biopolymère formé par des monomères d'acide α-aminé unis à travers des liaisons peptidiques. Chaque protéine a une séquence définie de ces acides aminés.
Les protéines remplissent une énorme diversité de fonctions biologiques, y compris la forme et maintiennent l'intégrité des cellules par le cytosquelette, défendent le corps d'agents étranges à travers des anticorps et catalysent les réactions chimiques de l'organisme par le biais d'enzymes.
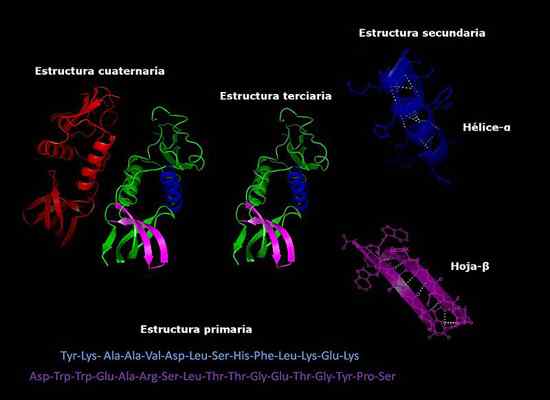
 Structures primaires, secondaires, tertiaires et quaternaires des protéines, conformation à trois dimensions. Pris et édité à partir de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)].
Structures primaires, secondaires, tertiaires et quaternaires des protéines, conformation à trois dimensions. Pris et édité à partir de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Actuellement, la détermination de la composition des protéines et l'ordre dans lequel les acides aminés (séquençage) sont organisés est plus rapide qu'il y a des années. Ces informations sont déposées dans les bases de données électroniques internationales, qui peuvent être accessibles via Internet (Genbank, PIR, entre autres).
[TOC]
Acides aminés
Les acides aminés sont des molécules qui contiennent un groupe amino et un groupe d'acide carboxylique. Dans le cas des acides α-aminés, ils ont un atome de carbone central (carbone α) auquel ils sont unis, le groupe amino et le groupe carboxyle, en plus d'un atome d'hydrogène et d'un groupe R distinctif, qui est appelé côté chaîne.
En raison de cette configuration de carbone α, les acides aminés formés, appelés acides α-aminés, sont des chiraux. Il existe deux formes qui sont des images miroir les unes des autres et qui sont appelées énantiomères L et D.
Toutes les protéines des êtres vivants sont formées par 20 α-acides adino Configuration L. Les chaînes latérales de ces 20 acides aminés sont différentes et ont une grande diversité de groupes chimiques.
Fondamentalement, les acides α-aminés peuvent être regroupés (arbitrairement) en fonction du type de chaîne latérale de la manière suivante.
Acides aminés aliphatiques
Dans ce groupe, ils sont contenus, selon certains auteurs, de la glycine (GLI), de l'alanine (aile), de la valine (Val), de la Leucina (Leu) et de l'isoleucine (ILE). D'autres auteurs incluent également la métification (MET) et la proline (Pro).
Peut vous servir: phospholipides: caractéristiques, structure, fonctions, typesAcides aminés avec des chaînes latérales contenant de l'hydroxyle ou du soufre
Il contient la sérine (SER), la cystéine (Cys), le Treonina (THR) et aussi la métionine. Selon certains auteurs, le groupe ne devrait inclure que l'être et.
Acides aminés cycliques
Intégré uniquement par la proline, qui, comme cela l'a déjà souligné, est inclus par d'autres auteurs parmi les acides aminés aliphatiques.
Acides aminés aromatiques
Phénylalanine (Phe), tyrosine (Tyr) et triphafano (TRP).
Acides aminés de base
Histidine (His), Lysine (Lys) et Arginina (Arg)
Acides aminés acides et ses amides
Il contient des acides aspartiques (ASP) et du glutamique (GLU) et également de l'asparne (ASN) et du glutamine (GLN). Certains auteurs séparent ce dernier groupe en deux; D'une part, celle des acides aminés acides (les deux premiers), et de l'autre ceux contenant du carboxylamide (les deux autres).
Liens peptidiques
Les acides aminés peuvent se joindre les uns les autres via des liens peptidiques. Ces liens, également appelés liens Amida, sont établis entre le groupe α-amino d'un acide aminé et le groupe α-carboxyle d'un autre. Cette union est formée avec la perte d'une molécule d'eau.
L'union entre deux acides aminés se traduit par la formation d'un diphéptide, et si de nouveaux acides aminés sont ajoutés, séquentiellement, tripid, tétrapéptides, etc.
Les polypeptides formés par un petit nombre d'acides aminés reçoivent le nom général des oligopeptides, et si le nombre d'acides aminés est élevé, alors les polypeptides sont appelés.
Chaque acide aminé qui est ajouté à la chaîne polypeptidique libère une molécule d'eau. La partie de l'acide aminé qui a perdu le H + ou OH- pendant l'union, est appelée le reste de l'acide aminé.
La plupart de ces chaînes d'oligopeptides et de polypeptides présenteront, à une extrémité, un groupe amino-terminal (N-terminal), et dans l'autre un carboxyle terminal (C-terminal). En plus de cela, ils peuvent contenir de nombreux groupes ionisables entre les chaînes latérales des déchets d'acides aminés qui les composent. Pour cette raison, les polyanfolites sont considérées.
Peut vous servir: flore et faune de Campeche: espèces représentatives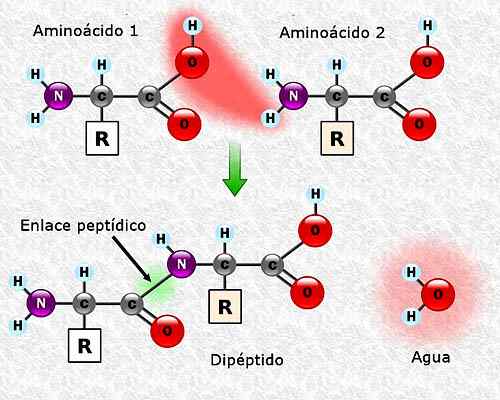 Formation d'un lien peptidique entre deux acides aminés. Pris et édité à partir de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)].
Formation d'un lien peptidique entre deux acides aminés. Pris et édité à partir de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Séquence d'acides aminés
Chaque protéine a une certaine séquence de ses déchets d'acides aminés. Cet ordre est ce que l'on appelle la structure principale de la protéine.
Chaque protéine individuelle de chaque organisme est spécifique à l'espèce. C'est-à-dire que la myoglobine d'un être humain est identique à celle d'un autre être humain, mais a de petites différences avec les myoglobines d'autres mammifères.
La quantité et les types d'acides aminés dont contient une protéine est aussi important que l'emplacement de ces acides aminés dans la chaîne polypeptidique. Pour connaître les protéines, les biochimistes doivent d'abord isoler et purifier chaque protéine particulière, puis faire une analyse de la teneur en acides aminés, et enfin déterminer sa séquence.
Pour isoler et purifier les protéines, il existe différentes méthodes, parmi lesquelles: la centrifugation, la chromatographie, la filtration du gel, la dialyse et l'ultrafiltration, ainsi que l'utilisation de propriétés de solubilité des protéines à l'étude dans l'étude.
La détermination des acides aminés présents dans les protéines est effectuée après trois étapes. La première consiste à briser les liaisons peptidiques par hydrolyse. Par la suite, les différents types d'acides aminés du mélange sont séparés; Et enfin, chacun des types d'acides aminés obtenus est quantifié.
Pour déterminer la structure primaire de la protéine, différentes méthodes peuvent être utilisées; Mais actuellement la plus utilisée est la méthode d'Edman, qui se compose essentiellement du marquage et de la séparation de l'acide aminé N-terminal du reste de la chaîne à plusieurs reprises, et d'identifier chaque acide aminé libéré individuellement.
Codage des protéines
La structure principale des protéines est codée dans les gènes d'organisme. Les informations génétiques sont contenues dans l'ADN, mais pour la traduction des protéines, la traduction doit d'abord être transcrite aux molécules RNM. Chaque triplet nucléotide (codon) code pour un acide aminé.
Peut vous servir: quelle est la composition chimique des êtres vivants?Parce qu'il y a 64 codons possibles et que seulement 20 acides aminés sont utilisés dans la construction de protéines, chaque acide aminé peut être codé par plus d'un codon. Pratiquement tous les êtres vivants utilisent les mêmes codons pour coder les mêmes acides aminés. Par conséquent, le code génétique est considéré comme un langage presque universel.
Dans ce code, il y a des codons utilisés pour démarrer et également arrêter la traduction des polypeptides. Les codons d'achèvement ne codent pas d'acide aminé, mais arrêtent la traduction dans la chaîne C-terminal et sont représentées par les triplés UAA, UAG et UGA.
D'un autre côté, le codon AUG fonctionne normalement comme un signal de départ et code également.
Après la traduction, les protéines peuvent subir un traitement ou une modification, telle qu'une courte durée, pour obtenir sa configuration définitive.
Les références
- C.K. Mathews, k.ET. Van Hold & K.g. Ahern. 2002. Biochimerie. 3e Édition. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. mille neuf cent quatre vingt seize. Biochemery de Harper. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (SF). Biochimerie. 5e Édition. W. H. Freeman et compagnie.
- J. Koolman & k.-H. Roehm (2005). Atlas de la couleur de la biochimie. 2Nd Édition. Thieme.
- POUR. Lehninger (1978). Biochimie. Éditions Omega, S.POUR.
- L. Stryer (1995). Biochimerie. W.H. Freeman and Company, New York.
- « Historique des nombres Avogadro, unités, comment il est calculé, utilise
- Caractéristiques, structure et fonctions d'exonucléase »

